|
CARATTERISTICA ELETTRICA
Le semireazioni
d’ossidazione e riduzione che avvengono in una cella a
combustibile avvengono spontaneamente e perciò
comportano una diminuzione dell'energia libera del
sistema (∆G < 0).
Come avviene in una cella galvanica, il flusso
d’elettroni è dovuto ad una differenza di potenziale
tra i due elettrodi. Essa è detta forza elettromotrice
reversibile (f.e.m.) della cella.
Una cella a combustibile, quindi, è un sistema capace
di produrre energia elettrica (W)
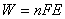 (3.14)
(3.14)
dove E è la f.e.m. reversibile della cella; n è il
numero di moli d’elettroni coinvolti nella reazione; F
(costante di Faraday) è la quantità di carica
elettrica trasportata da una mole d’elettroni e pari a
96487 C.
Per il principio di conservazione dell’energia (Primo
Principio della Termodinamica), in condizioni
d’equilibrio, la massima quantità d’energia elettrica
che si può ottenere da una cella, che opera a
temperatura e pressione costante, è pari alla
variazione d’energia libera di Gibbs:
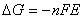 (3.15)
(3.15)
La quantità di calore prodotta è data dalla (3.16) in
cui ∆H è la variazione d’entalpia e ∆S è la variazione
d’entropia
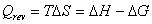 (3.16)
(3.16)
La f.e.m. reversibile di una cella dipende dalla
temperatura e dalle concentrazioni delle specie in
soluzione. In condizioni standard, la massima tensione
ottenibile da una cella idrogeno e ossigeno è di 1,229
V. Per ricavare la f.e.m. in condizioni di
temperatura, concentrazione e pressione diverse da
quelle standard si usa l’equazione di Nerst.
In generale, la f.e.m. reversibile di una cella
combustibile diminuisce al crescere della temperatura
e aumenta al crescere delle pressioni e delle
concentrazioni dei reagenti.
In realtà, la tensione erogata da una cella a
combustibile, è sempre minore rispetto a quella ideale
e questo è dovuto a causa di cadute di potenziale.
CORRENTE ELETTRICA PRODOTTA
La corrente
elettrica prodotta da una cella a combustibile può
essere ricavata applicando la Legge di Faraday. Essa
afferma che in seguito al passaggio di 96500 C (1 F)
attraverso la cella, si verifica la riduzione di una
mole d’ossigeno al catodo e l’ossidazione di una mole
d’idrogeno all’anodo.
Indicando con I la corrente totale che scorre nella
cella, essa la si può esprimere, attraverso la legge
di Faraday, con la (3.17) che evidenza come il valore
della corrente sia legato alla quantità di
combustibile impiegata per alimentare la cella
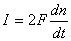 (3.17)
(3.17)
dove il termine dn/dt rappresenta la velocità con cui
si consumano le specie reagenti.
In altri termini, la (3.17) rappresenta la quantità
massima di corrente teoricamente ottenibile da una
cella a combustibile.
In realtà, non tutto l’idrogeno viene convertito in
corrente perché una sua piccola parte viene espulsa
con i prodotti dalla reazione.
VANTAGGI E SVANTAGGI NELL’USO DELLE CELLE
Le celle a
combustibile potrebbero assumere un ruolo strategico
nelle generazione elettrica sia nel settore
industriale che in quello civile e del trasporto, in
quanto presentano una serie di vantaggi rispetto ai
tradizionali metodi di produzione dell’energia.
I principali vantaggi sono:
◊Minimo impatto
ambientale
◊Rendimento
elettrico elevato (il passaggio dell’energia avviene
in maniera diretta senza il passaggio intermedio, né
della combustione né dell’azione meccanica di turbine
o pistoni)
◊Flessibilità
nell’esercizio (gli impianti si adeguano velocemente
alle variazioni di carico)
◊Affidabilità
(l’assenza di parti meccaniche in movimento permette
alle celle di funzionare per lunghi periodi senza il
bisogno di controlli e manutenzione)
◊Possibilità
d’utilizzo di una grande varietà di combustibili
I principali svantaggi sono:
◊Problemi economici
(elevato costo degli impianti e del combustibile)
◊Problemi tecnici
(difficoltà d’immagazzinamento dell’idrogeno in
maniera sicura ed efficiente; mancanza di un’adatta
rete di trasporto e distribuzione del combustibile)
|