|
ELETTROCHIMICA DELLA CELLA
Il funzionamento di
una cella a combustibile è basato sulla reazione
d’ossidoriduzione
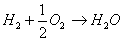 (3.1)
(3.1)
che avviene a temperatura e pressione costante. Le
semireazioni che la compongono sono diverse a seconda
del tipo di cella adoperata.

Nella cella PAFC, l’elettrolita
adoperato è l’acido fosforico (H3PO4) mentre il
combustibile e l’ossidante sono costituiti da ossigeno
ed idrogeno. Quando l’idrogeno viene introdotto nel
compartimento anodico della cella, entrando a contatto
con il catalizzatore (platino) che riveste l’elettrodo
dà luogo a due fenomeni contemporanei:
◊L’idrogeno che
attraversa l’elettrodo cede ioni positivi (H+) alla
soluzione lasciando sugli atomi solo l’elettrone di
valenza e facendo assumere all’elettrodo un potenziale
negativo
◊Gli ioni in
soluzione tendono ad accumularsi sulla superficie
dell’elettrodo a potenziale negativo
I due fenomeni avvengono inizialmente a velocità
diverse. La velocità con cui gli ioni H+ vanno in
soluzione è maggiore di quella in cui gli ioni in
soluzione si accumulano sulla superficie
dell’elettrodo. Al procedere della reazione, la
cessione di ioni H+ alla soluzione viene ostacolata
dal fatto che essa tende ad assumere un potenziale
positivo.
Di conseguenza la velocità con cui gli ioni vanno in
soluzione tende a diminuire e contemporaneamente
quella con cui gli ioni tendono a depositarsi
sull’elettrodo aumenta.
Ad un certo punto si arriva ad una condizione
d’equilibrio dove i due fenomeni tendono ad avere la
stessa velocità. Questa situazione è rappresentata
dalla reazione d’ossidazione il cui effetto è di far
assumere all’elettrodo (anodo) potenziale negativo e
di rifornire l’elettrolita con ioni idrogeno H+.
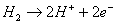 (3.11)
(3.11)
Gli elettroni (e-) scorrono attraverso il circuito
esterno fino all’altro elettrodo (catodo), nel cui
compartimento viene fatto entrare ossigeno che subisce
il processo di riduzione:
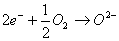 (3.12)
(3.12)
Gli ioni O2-, appena prodotti, si legano con due ioni
H+ che provengono dall’elettrolita acido e che possono
attraversare l’elettrodo poroso. Si produce cosi
acqua.
La reazione complessiva che avviene al catodo è:
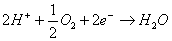 (3.13)
(3.13)
In sintesi, durante il funzionamento si ha
circolazione di corrente e sviluppo di calore con
espulsione d’acqua al catodo.
Da notare che le semireazioni d’ossidazione e
riduzione che avvengono in una cella PAFC sono
esattamente le stesse di quelle coinvolte in una cella
PEFC ad elettrolita polimerico e che in tutte le altre
celle, ad eccezione di quelle citate e delle DMFC,
l’espulsione d’acqua avviene all’anodo. |