CALCOLO DEL pH E DELLA CURVA pH/ml
ESERCIZIO
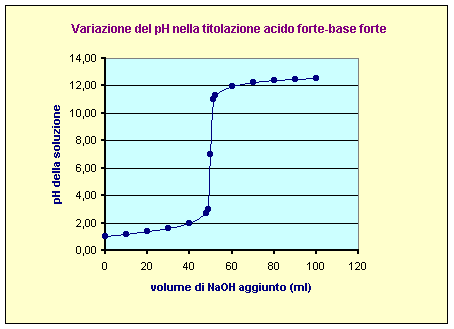
Si devono titolare 50 ml di una soluzione 0,1 N di HCl con una soluzione 0,1 N di NaOH. Ricavare il pH della soluzione iniziale e delle soluzioni ottenute dopo l’aggiunta di 10 ml, 20 ml, 30 ml, 40 ml, 48 ml, 49 ml, 50 ml, 51 ml, 52 ml, 60 ml, 70 ml, 80 ml di NaOH. Disegnare l’andamento del pH nel grafico pH/ml.
![]()
a titolo d’esempio calcoliamo:
il pH: 1. iniziale; 2. all’aggiunta di 20ml di NaOH; 3. al punto equivalente (
quando sono stati aggiunti 50 ml di NaOH); 4. all’aggiunta di 70 ml di NaOH.
1. Essendo presente
inizialmente in soluzione solo HCl, acido forte, il pH si ricava dalla formula:
pH = –log[H3O+] = -log 0,1 = 1;
2. Dalla stechiometria
semplice della reazione di neutralizzazione HCl + NaOH = NaCl + H2O,
calcolando gli equivalenti iniziali di HCl = N·V= 0,1·0,05= 0,005 e quelli
aggiunti di NaOH = N·V= 0,1·0,02= 0,002, si ricavano quelli di HCl in eccesso:
0,005-0,002= 0,003. Questi si ritrovano in un volume di 50 ml + 20 ml = 70 ml.
Pertanto la concentrazione dell’acido residuo è N= 0,003/0,07= 0,043 eq/litro.
Il pH è: pH= -log0,043= 1,37.
3. Al punto equivalente,
non essendovi alcun eccesso di acido o di base, gli ioni idrogeno esistenti
derivano unicamente dall’equilibrio di autoprotolisi dell’acqua. Pertanto il pH
=7.
4. Quando si aggiungono 70
ml di NaOH, il punto di equivalenza è stato già abbondantemente superato. Dei
70 ml aggiunti, 50 sono stati impegnati nella reazione di neutralizzazione.
Perciò vi sono 20 ml di base in eccesso, pari a N·V= 0,1·0,02= 0,002
equivalenti, in un volume di 50 ml + 70 ml = 120 ml. La concentrazione di NaOH
è perciò: N=0,002/0,120 = 0,0167 eq/litro. Il pOH è perciò: pOH = - log[OH-]=
-log 0,0167=1,78. Quindi il pH è:
14 – pOH=12,22. I
risultati completi dei calcoli e la curva del pH sono illustrati qui sotto:
|
Volume di NaOH aggiunto
(ml) |
numero di equiv. di HCl residui |
concentra-zione residua di HCl |
concentra-zione residua di NaOH |
pH |
|
0 |
0,005 |
0,100 |
0 |
1,00 |
|
10 |
0,004 |
0,067 |
0 |
1,18 |
|
20 |
0,003 |
0,043 |
0 |
1,37 |
|
30 |
0,002 |
0,025 |
0 |
1,60 |
|
40 |
0,001 |
0,011 |
0 |
1,95 |
|
48 |
0,0002 |
0,002 |
0 |
2,69 |
|
49 |
0,0001 |
0,001 |
0 |
3,00 |
|
50 |
0 |
0 |
0 |
7,00 |
|
51 |
0 |
0 |
0,001 |
11,00 |
|
52 |
0 |
0 |
0,002 |
11,29 |
|
60 |
0 |
0 |
0,009 |
11,96 |
|
70 |
0 |
0 |
0,017 |
12,22 |
|
80 |
0 |
0 |
0,023 |
12,36 |
|
90 |
0 |
0 |
0,029 |
12,46 |
|
100 |
0 |
0 |
0,033 |
12,52 |