![]() Home page
Home page
![]() torna
al menu terze classi
torna
al menu terze classi
I gas si combinano tra loro secondo rapporti volumetrici e ponderali ben precisi e definiti. Per esempio, in riferimento alla reazione di formazione dell’acqua, possiamo scrivere i seguenti dati sperimentali:
a) 2 volumi di
idrogeno + 1 volume di ossigeno → 2 volumi di acqua
(ovviamente i volumi devono essere misurati nelle medesime condizioni di pressione e temperatura)
b)
Qualunque aggiunta dei reagenti in eccesso rispetto a tali
rapporti non entra in combinazione. Questo porta ad una prima conclusione: il numero di molecole contenute in un determinato volume di
gas deve essere esattamente definito.
Dagli esperimenti di Loschmidt sulle velocità di diffusione relative di due gas, per la prima volta fu possibile calcolare il rapporto ponderale tra le loro molecole. In particolare, per l’idrogeno e l’ossigeno, Loschmidt ricavò il seguente rapporto:
c)
massa molecolare dell’ossigeno/massa
molecolare dell’idrogeno = 16
Quest’ultimo dato significa semplicemente che se disponessimo di una bilancia sensibile alla massa di una molecola (il che è impossibile) e mettessimo su un piattello di questa una molecola di ossigeno, per riequilibrarla dovremmo porre sull’altro piattello ben 16 molecole di idrogeno.
Se
facciamo l’ipotesi più semplice che nella reazione di formazione dell’acqua una
molecola di idrogeno reagisca con una molecola di ossigeno, il rapporto
ponderale sperimentale tra i due elementi che si dovrebbe riscontrare
sarebbe:
In realtà il rapporto è 1/8=2/16.
Allora una spiegazione accettabile è che nella reazione di formazione
dell’acqua debbano necessariamente reagire 2
molecole di idrogeno con 1 molecola di ossigeno.
Il rapporto molecolare di combinazione così trovato è esattamente uguale al rapporto volumetrico di combinazione (equazione b).
Questo risultato permette di formulare l’ipotesi che volumi uguali di gas differenti, misurati nelle stesse condizioni di pressione e temperatura contengono lo stesso numero di molecole. Tutti gli esperimenti sono in accordo con tale ipotesi, la quale perciò, a ragione, assume il rango di legge, ed è detta appunto LEGGE DI AVOGADRO.
Tale legge consente di determinare in molti importanti casi il numero di atomi di un elemento o di vari elementi contenuto in una molecola, cioè di determinare la formula bruta o grezza di diverse sostanze gassose.
La chimica non dispone di un metodo diretto, sperimentale, per determinare la formula bruta. Dobbiamo perciò procedere attraverso diverse ipotesi, accettando quella più semplice che sia in accordo con le osservazioni sperimentali. Riferendoci sempre alla reazione di formazione dell’acqua, supponiamo che le molecole di idrogeno e di ossigeno siano costituite ciascuna da un singolo atomo (molecole monoatomiche). Considerando i dati volumetrici alla luce della legge di Avogadro, supponendo idealmente che in ogni volume sia presente una molecola sola:



![]()
![]()
![]() +
+
![]()
![]()
![]()
![]()
2 volumi di H 1 volume di O 2 volumi di acqua
si può notare subito che l’ipotesi di monoatomicità per la molecola dell’ossigeno è insostenibile, poiché dalla legge di Proust sappiamo che gli atomi entrano in combinazione come unità intere. Producendosi 2 molecole d’acqua, poiché in ciascuna deve essere necessariamente presente almeno un atomo di ossigeno, ne deriva che la molecola di ossigeno deve contenere almeno due atomi (O2). Osservando la figura si può notare che l’ipotesi di monoatomicità della molecola di idrogeno può essere ancora considerata valida (in tal caso la formula chimica dell’acqua sarebbe OH). Per dare una risposta definitiva riguardo alla formula molecolare dell’idrogeno, dobbiamo allora considerare un’altra reazione in fase gassosa in cui esso è coinvolto, ad esempio la reazione con azoto nella quale si produce ammoniaca. I dati volumetrici sperimentali sono i seguenti:



![]() +
+
3 volumi di H 1 volume di N 2 volumi di ammoniaca
Un’analisi attenta della figura ci permette di concludere che, analogamente a quanto detto prima per l’ossigeno, anche la molecola dell’azoto deve essere biatomica (N2). Inoltre, sempre per la legge di Pruost, la molecola di idrogeno deve essere necessariamente biatomica (H2). Infine possiamo concludere che la formula bruta dell’ammoniaca deve essere NH3 e che l’equazione chimica bilanciata con cui si può esprimere la suddetta reazione è:
3H2 + 1N2 = 2NH3
La determinazione della formula molecolare
dell’idrogeno è stata particolarmente importante, poiché tale elemento è stato
scelto come riferimento per i pesi atomici e molecolari relativi. Pertanto ora possiamo definire
MOLE di una sostanza semplice o composta come la massa di tale sostanza entro
cui vi sono lo stesso numero di molecole contenute in

![]()
![]()
![]()
![]() H2
H2
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() CO2
CO2
22![]()
![]()
![]()
![]()
![]()
il
rapporto delle masse di gas contenenti al loro interno lo stesso numero di
molecole equivale al rapporto della massa di una molecola di un gas rispetto a
quella di una molecola dell’altro. Nell’esempio riportato nella figura,
possiamo dire in modo equivalente che la massa di un certo volume di anidride
carbonica (CO2) è 22
volte più grande della massa di idrogeno (H2) contenuta nello stesso volume, o che la massa di una
molecola di anidride carbonica è 22 volte più grande della massa di una
molecola di idrogeno. Ora, poiché la molecola di idrogeno è biatomica, e poiché
il peso atomico o molecolare relativo di una sostanza viene riferito alla massa
di un atomo di idrogeno e non alla molecola di idrogeno, ne deriva che il peso molecolare della CO2
deve essere:
22 x
2 = 44
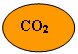
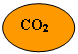 Nel linguaggio dei fumetti:
Nel linguaggio dei fumetti:
![]()
![]()
![]()
![]()
![]() = 22 ; = 44
= 22 ; = 44
Molte misure effettuate con mezzi chimici e fisici hanno permesso di determinare il numero di particelle presenti in una mole di qualsivoglia sostanza. Il valore di tale numero, chiamato NUMERO DI AVOGADRO, è: 6,06×1023.
Infine, da quanto visto,
osserviamo che se prendiamo una mole di atomi di idrogeno, cioè
Possiamo quindi definire la mole di un elemento o di un composto in modo operativo, e quindi utile dal punto di vista pratico: per mole di qualsivoglia sostanza si intende una massa di questa, espressa in grammi, numericamente uguale al suo peso atomico o molecolare.
In generale, perciò per calcolare il numero di moli presenti in una certa quantità di sostanza, possiamo impostare la seguente proporzione:
1 mole :
peso molecolare o atomico espresso in grammi = n moli : massa data
espressa in grammi
da cui:
n = gr/PM