Sito di Vinicio Coletti
La materia e le radiazioni nucleari
Torna all'indice del materiale educativoLe particelle elementari | |||||||||||||||||||||
|
Nella ricerca dei costituenti elementari della materia, i fisici ritengono per ora che
esistano due classi di particelle elementari: i quark ed i leptoni.
Esistono molti tipi di quark e leptoni, ma molti di essi hanno una vita
molto breve e possono essere osservati solo negli esperimenti dei laboratori
di fisica delle alte energie, come il Cern di Ginevra. Tutta la materia ordinaria che osserviamo nella vita di tutti i giorni è costituita da sole tre particelle elementari: 1) Il quark up 2) Il quark down 3) L'elettrone Ogni particella elementare si differenzia dalle altre per una serie di valori, come la massa, la carica elettrica ed altre ancora. Per ogni particella esiste una anti-particella che si distingue da quella "normale" solo perché ha una carica elettrica esattamente opposta. Nella tabella che segue sono illustrati questi valori per le tre particelle che costituiscono la materia ordinaria.
|

|
||||||||||||||||||||
|
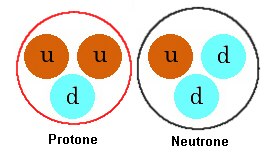
Queste particelle possono aggregarsi in molti modi diversi, ma nella materia ordinaria
sono presenti solo due aggregati formati da 3 quark e poi l'elettrone. I
quark non sono mai osservati isolatamente. Abbiamo quindi a che fare con le seguenti tre particelle:
|
|
||||||||||||||||||||
Atomi e molecole | |||||||||||||||||||||
|
Come si sa, particelle che hanno lo stesso segno della carica elettrica si respingono,
mentre particelle con carica opposta si attraggono. Sembrerebbe dunque impossibile che
più protoni si uniscano insieme, ma ciò avviene, perché la stessa forza che unisce i quark
all'interno degli adroni, la forza nucleare forte, serve anche ad unire più protoni
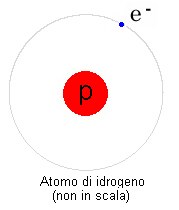
e neutroni tra di loro, formando il nucleo atomico. La carica elettrica complessiva del nucleo sarà quindi data semplicemente dal numero dei protoni presenti, visto che i neutroni non hanno carica. Man mano che aumenta il numero dei protoni, diventa indispensabile la presenza dei neutroni, senza i quali la carica elettrica finirebbe con il prevalere. In effetti non esistono nuclei formati da molti protoni e nessun neutrone. Visto che il nucleo ha carica elettrica positiva, si forma intorno una nube di elettroni, che hanno carica negativa e sono quindi attratti dal nucleo. In condizioni normali ci sarà intorno al nucleo un numero di elettroni pari al numero di protoni nel nucleo. In questo caso la carica complessiva dell'atomo sarà pari a zero, avremo cioè un atomo neutro. In altri casi l'atomo potrà avere degli elettroni in più o in meno ed in questo caso si parla di atomo ionizzato, con carica positiva o negativa. Le nubi degli elettroni di vari atomi contigui possono interagire e gli atomi possono così unirsi a formare delle strutture più grandi, chiamate molecole. La strutture più complesse, tutte basate sul carbonio, sono quelle dette organiche, che sono alla base della vita (un tipico esempio è la molecola del DNA). Lo studio delle molecole è il campo d'indagine della chimica. |
|
||||||||||||||||||||
Elementi ed isotopi |
|
||||||||||||||||||||
|
Nel classificare gli atomi, si è dato un nome diverso ad ogni elemento, caratterizzato
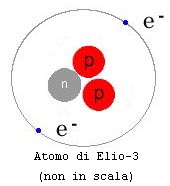
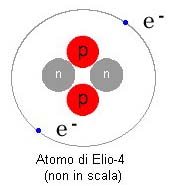
da un certo numero di protoni nel nucleo, detto numero atomico. Ad esempio definiamo idrogeno (H) tutti gli atomi che hanno un solo protone nel nucleo, chiamiamo elio (He) tutti gli atomi con 2 protoni nel nucleo, mentre il carbonio (C) avrà sempre 6 protoni, ecc. Sono stati finora osservati poco più di 110 elementi diversi, compresi quelli creati artificialmente. All'interno dello stesso elemento possiamo avere nuclei che, pur avendo lo stesso numero di protoni, hanno un diverso numero di neutroni. Queste varietà sono definite isotopi, per distinguere i quali si dà il conteggio complessivo di barioni (protoni + neutroni) nel nucleo, valore definito come peso atomico. Ad esempio l'elio (numero atomico=2) esiste sotto forma di due isotopi: 3He, Elio-3, che ha nel nucleo 2 protoni e 1 neutrone 4He, Elio-4, che ha nel nucleo 2 protoni e 2 neutroni In natura la quantità dei vari isotopi non è uniforme, ad esempio 4He è molto più diffuso di 3He. |
|||||||||||||||||||||
Nuclei stabili ed instabili | |||||||||||||||||||||
|
Come si è detto, gran parte delle particelle elementari e composte non sono stabili,
ovvero, dopo un periodo di tempo che è possibile determinare solo statisticamente,
decadono, ovvero si trasformano in qualcos'altro. Delle 3 particelle che formano la
materia ordinaria, il protone e l'elettrone sono stabili mentre, sorpresa, il
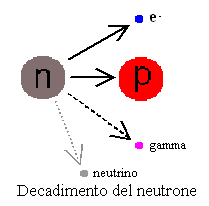
neutrone (isolato) decade con tempo di dimezzamento di 876 secondi. E' impossibile conoscere l'istante in cui un certo neutrone decadrà, ma la probabilità è nota, per cui per la legge dei grandi numeri, su grandi insiemi di neutroni, la previsione è certa e normalmente si esprime nel tempo necessario al decadimento di metà degli elementi considerati. Ad esempio, se abbiamo a che fare con 1 miliardo di neutroni isolati, dopo poco meno di un quarto d'ora mezzo miliardo sarà decaduto, trasformandosi in protone, mentre l'altro mezzo miliardo sarà ancora lì. Dopo altri 876 secondi, altri 250 milioni di neutroni (la metà della metà rimasta) saranno decaduti, e così via. Tuttavia quando il neutrone è legato all'interno di un nucleo atomico, diventa stabile, per lo meno nella maggior parte dei casi ed è questo fatto che rende possibile l'esistenza della materia come la conosciamo, compresa quella vivente. Lo stesso discorso sulla stabilità e instabilità del neutrone, riguarda i nuclei atomici. Alcuni sono, diciamo così, ben costruiti, per cui i neutroni si trovano a loro agio e sono stabili e non ci sono problemi strutturali. In altri casi, o perché i neutroni ridiventano instabili o perché la struttura tende a non reggere, il nucleo è instabile. |
 |
||||||||||||||||||||
Decadimento atomico e radiazioni | |||||||||||||||||||||
|
Quando un nucleo decade, si trasforma in un nucleo di un elemento diverso. Si noti
che questo è esattamente ciò che volevano realizzare gli alchimisti dei secoli
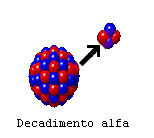
passati e che in realtà avviene spontaneamente in natura! Esistono due tipi fondamentali di decadimento: - il decadimento alfa in cui l'atomo si spezza perdendo 2 protoni e 2 neutroni, cioè un nucleo di 4He. Questo nucleo di elio sparato via ad alta velocità viene definito radiazione alfa. Inoltre spesso il nucleo principale viene a trovarsi in uno stato eccitato, dopo essersi spezzato, e ritorna ad uno stato di minore energia emettendo onde luminose di brevissima lunghezza d'onda, dette radiazione gamma. - il decadimento beta, in cui uno dei neutroni del nucleo si trasforma in protone, con emissione di elettroni molto energetici (radiazione beta), di antineutrini e di radiazione gamma. I neutrini sono la sola cosa di cui non dobbiamo preoccuparci, visto che interagiscono pochissimo con la materia, mentre gli altri tre tipi di radiazione sono molto pericolosi per la salute, anche se il loro comportamento è differenziato. I raggi alfa sono molto energetici ed in grado di provocare seri danni alle strutture molecolari incontrate. Tuttavia, interagendo molto con la materia, non sono in grado di attraversare grandi spessori e possono essere schermati abbastanza facilmente. Posti a contatto con strutture viventi sono però molto pericolosi, specie se il contatto è prolungato nel tempo. I raggi alfa hanno carica positiva e sono quindi deviati dai campi magnetici. I raggi beta, essendo costituiti dai più leggeri elettroni, sono più penetranti e più difficili da schermare ed anche loro in grado di provocare seri danni alle strutture biologiche. Avendo carica negativa, sono anche loro deviati dai campi magnetici. I raggi gamma sono radiazione elettromagnetica di brevissima lunghezza d'onda e sono molto penetranti, nonché in grado di danneggiare le molecole organiche. Essendo neutri, non sono deviati dai campi magnetici. |
|
||||||||||||||||||||
I danni provocati dalle radiazioni nucleari | |||||||||||||||||||||
|
Come si è detto, la vita è basata su complesse e grandi molecole organiche,
basate sul carbonio. I legami tra queste molecole avvengono attraverso
l'interazione tra le nubi di elettroni dei vari atomi e sono legami
molto più delicati di quelli che sussistono all'interno dei nuclei. Ogni radiazione ionizzante, cioè in grado di strappare via gli elettroni da un certo atomo neutro, trasformandolo in ione, è in grado dunque anche di spezzare i legami che esistono all'interno delle molecole organiche, provocando seri danni. Sono radiazioni ionizzanti sia i raggi alfa che i raggi beta, nonché, se consideriamo la radiazione elettromagnetica, i raggi ultravioletti, i raggi X ed i raggi gamma. Dunque tutti e tre i tipi di radiazione nucleare (α, β e γ) sono nocivi. Il danno può consistere nella morte della cellula che contiene la molecola colpita da questi proiettili oppure, se si è sfortunati, nella sua trasformazione in cellula cancerosa, pronta a riprodursi in modo incontrollato. Tutto dipende anche, naturalmente, dalla quantità e qualità delle radiazioni a cui si è esposti, nonché dalla durata dell'esposizione. Ad esempio, nel corso di una esplosione atomica, si può essere investiti da una quantità di radiazioni tale da provocare la morte di enormi quantità di cellule, per cui l'organismo soccombe immediatamente o in pochissimo tempo. Viceversa, esposizioni più basse ma prolungate nel tempo, come avviene in chi assorbe sostanze radioattive o vive in ambienti contaminati, può provocare malattie come il cancro o la leucemia, a distanza di tempo. Se a venire colpita è la molecola del DNA, si potranno inoltre verificare delle mutazioni, cioè modifiche al codice genetico umano che sono trasmissibili alle generazioni future. Ovvero le radiazioni producono la sola forma di danno che si propaga anche ai discendenti. |
 |
||||||||||||||||||||
La radioattività naturale | |||||||||||||||||||||
|
In natura siamo comunque esposti ad una certa quantità di radiazioni nucleari, che
non è putroppo possibile eliminare. Il fatto che siano naturali, infatti, non implica
che siano innocue. Anche queste radiazioni sono in grado di provocare danni
al nostro organismo. Possiamo citare ad esempio l'isotopo instabile (radioattivo) del carbonio, il 14C, che è presente, insieme al più comune e stabile 12C, nel nostro organismo. Oppure si possono considerare i raggi cosmici, radiazioni di altissima energia provenienti dal centro della galassia e da eventi cosmici. Il fatto che le radiazioni siano comunque nocive ci fa capire che dobbiamo tendere a minimizzare l'esposizione verso di esse, evitando in particolare di aggiungere fonti artificiali alle ben note sorgenti naturali. La regola è molto semplice: meno radiazioni nucleari ci sono, di qualsiasi origine siano, meglio è. |
Immagini | ||||||||||||||||||||
L'uranio | |||||||||||||||||||||
|
L'uranio (U) è un elemento caratterizzato dal numero atomico 92, ovvero
avente 92 protoni nel nucleo. L'isotopo più comune che si trova in natura è
238U e non esistono isotopi stabili di questo elemento. Ciò significa che quando si parla di uranio, qualsiasi aggettivo lo preceda o lo segua, stiamo sempre parlando di una sostanza radioattiva. L'uranio, come si sa, viene utilizzato nella costruzione delle bombe atomiche e come combustibile per le centrali nucleari. In entrambi i casi 238U non si presta molto bene perché, pur essendo radioattivo, non è molto facile spezzarne il nucleo sparandogli contro dei neutroni, nel processo detto di fissione nucleare. L'isotopo che funziona meglio in questo caso è 235U, presente in natura in quantità infinitesime. Si usano dunque dei processi artificiali di arricchimento tendenti a far aumentare la percentuale di 235U presente nel combustibile. Il risultato viene definito uranio arricchito. Dopo l'uso nella centrale, le barre di combustibile hanno perso gran parte del loro contenuto di 235U e sono ancora in gran parte fatte da 238U, oltre a tanti altri elementi, in gran parte anch'essi radioattivi. Visto che questo è un combustibile ormai utilizzato, sfruttato, esaurito (depleted), non è più utile per la produzione di energia. Ma ciò non significa che sia diventato innocuo, anzi è sicuramente più radioattivo dell'uranio naturale, per la presenza di svariati prodotti delle reazioni atomiche. E poi si tratta pur sempre di uranio, quindi radioattivo, quindi sempre e comunque molto pericoloso per la salute umana. Il tempo di dimezzamento dell'uranio-238 è pari a 4,5 miliardi di anni, il che significa che se abbiamo 1 kg di 238U dovremo aspettare 4,5 miliardi di anni per vederlo ridursi a mezzo chilo! Dunque ogni contaminazione da questa sostanza ha durata praticamente infinita e solo la diluizione dell'uranio nell'ambiente e nel sottosuolo può ridurre il danno locale, anche se eventuali inserimenti nella catena alimentare non possono che peggiorare la situazione. |
Immagini |