I Fullereni
![]()
 Cosa sono i
Fullereni
Cosa sono i
Fullereni
Oltre ai cluster del carbonio tipici:
carbonio amorfo, diamante e grafite, si è riusciti a sintetizzare,
attraverso procedure di laboratorio, un gran numero di nuovi clusters che
possono contenere al loro interno da 2 e 300 atomi di carbonio. Da C20
in su questi clusters tendono ad assumere una forma
sferoidale, mentre se ci troviamo al di sotto di C20, assumono la
forma di lunghe catene di atomi di carbonio, simili a quelle di alcuni polimeri
plastici, solo che in questo caso non vi sono sostituenti che insistono sugli
atomi di carbonio.
Fra i clusters
che tendono ad assumere forma chiusa, ve ne sono alcuni la cui struttura
ricorda quella di un pallone da calcio, a tali  clusters, i chimici hanno dato il nome di fullereni.
Fra di essi, quello che riveste maggiore importanza
nel campo della chimica e della scienza dei materiali, è, indubbiamente,
quello formato da 60 atomi di carbonio, cui i chimici hanno dato il nome di Buckminsterfullerene
(Bucky
per gli amici) per la somiglianza della sua forma geometrica con quella delle
cupole geodetiche disegnate dall’architetto Buckminster Fuller.
clusters, i chimici hanno dato il nome di fullereni.
Fra di essi, quello che riveste maggiore importanza
nel campo della chimica e della scienza dei materiali, è, indubbiamente,
quello formato da 60 atomi di carbonio, cui i chimici hanno dato il nome di Buckminsterfullerene
(Bucky
per gli amici) per la somiglianza della sua forma geometrica con quella delle
cupole geodetiche disegnate dall’architetto Buckminster Fuller.
Geometria dei
fullereni
Come si è già detto
precedentemente, i fullereni, da C20 in su
assumono una forma chiusa, forma che, nel caso del fullerene Bucky, è
simile alle cupole geodetiche disegnate 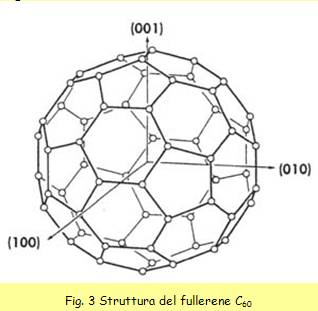 dall’architetto Buckminster Fuller.
Tale assetto geometrico viene definito icosaedro tronco e ricorda molto da
vicino la struttura di un pallone da calcio. Tale forma geometrica, deriva
dall’icosaedro, cui sono state sfaccettate le 20 facce in modo da
ottenere 12 pentagoni (vedi Fig. 3)
dall’architetto Buckminster Fuller.
Tale assetto geometrico viene definito icosaedro tronco e ricorda molto da
vicino la struttura di un pallone da calcio. Tale forma geometrica, deriva
dall’icosaedro, cui sono state sfaccettate le 20 facce in modo da
ottenere 12 pentagoni (vedi Fig. 3)
Tale struttura che conferisce una elevata stabilità alle cupole geodetiche, la
conferisce anche al fullerene C60. Elevata stabilità,
però, non implica anche una bassa reattività, infatti, come
vedremo in seguito, i fullereni possono dare un gran numero di reazioni, che
consentono al chimico di modellarne senza troppi problemi le caratteristiche
chimico-fisiche.
Struttura
elettronica dei fullereni
Per quanto riguarda l
struttura elettronica dei fullereni, si devono distinguere due differenti casi.
Infatti, in base al numero di atomi di carbonio da cui sono costituiti, come
abbiamo visto precedentemente, i fullereni possono assumere forma lineare
(n° atomi di carbonio < 20) oppure forma chiusa (n° atomi di
carbonio > 20). Nel caso dei fullereni con struttura lineare, si può
supporre che gli atomi di carbonio che li compongono siano ibridati sp3, con
una struttura del tipo:
¾ C º
C ¾
C º
C ¾
Per quanto riguarda invece i fullereni con
una struttura geometrica chiusa, il discorso si fa più complesso.
Ciò in quanto, come abbiamo visto precedentemente nel caso del fullerene
Bucky, questi tendono ad assumere una forma sferica.
 Sperimentalmente, si è osservato che
gli atomi di carbonio che costituiscono i fullerene
che vanno da C20 in su, possiedono orbitali ibridate sp2. Il che
potrebbe sembrare in netto contrasto con quanto detto a proposito della
struttura geometrica dei fullereni che vanno da C20. Infatti, se,
come è stato sperimentalmente provato, gli atomi di carbonio sono
ibridati sp2, allora la struttura geometrica del fullerene Bucky, ad esempio,
dovrebbe essere di tipo planare e non di tipo sferoidale. Questo significa che,
in realtà l’ibridazione sp2 degli orbitali degli atomi di carbonio
che compongono i fullereni, non è un sp2 pura,
ma è un sp2 “imbastardita” della componente s. Infatti, la struttura
geometrica sferoidale dei fullereni da C20 in su, impone una
deviazione di un certo angolo rispetto all’assetto planare. Tale angolo
prende il nome di angolo di piramidizzazione e nel caso del fullerene C60
è pari a 11,6°.
Sperimentalmente, si è osservato che
gli atomi di carbonio che costituiscono i fullerene
che vanno da C20 in su, possiedono orbitali ibridate sp2. Il che
potrebbe sembrare in netto contrasto con quanto detto a proposito della
struttura geometrica dei fullereni che vanno da C20. Infatti, se,
come è stato sperimentalmente provato, gli atomi di carbonio sono
ibridati sp2, allora la struttura geometrica del fullerene Bucky, ad esempio,
dovrebbe essere di tipo planare e non di tipo sferoidale. Questo significa che,
in realtà l’ibridazione sp2 degli orbitali degli atomi di carbonio
che compongono i fullereni, non è un sp2 pura,
ma è un sp2 “imbastardita” della componente s. Infatti, la struttura
geometrica sferoidale dei fullereni da C20 in su, impone una
deviazione di un certo angolo rispetto all’assetto planare. Tale angolo
prende il nome di angolo di piramidizzazione e nel caso del fullerene C60
è pari a 11,6°.
Per giustificare la presenza di tali
angoli, si deve presupporre, come abbiamo già accennato precedentemente,
una reibridizzazione, degli orbitali degli atomi di carbonio, intermedia fra
sp2 ed sp3, per la quale l’orbitale 2pz, abitualmente puro nel
caso di un’ibridazione sp2 normale, non lo sia più e quindi
contenga al suo interno una certa percentuale di carattere s. Percentuale, che
decrescerebbe all’aumentare del numero di atomi di carbonio che
compongono il fullerene, fino ad annullarsi nel caso limite della grafite. Un
simile andamento spetterebbe, come ovvio, anche all’angolo di
piramidizzazione.
La parziale ibridizzazione
dell’orbitale 2pz porta con se tutta una serie di conseguenze,
fra cui, quella che riveste maggiore importanza a livello pratico, è
data dal fatto che gli orbitali 2pz reibridati, presentano una
maggiore affinità elettronica, rispetto ai convenzionali orbitali
molecolari che si formano a partire da  convenzionali orbitali 2p. Il che è
legato al fatto che gli orbitali 2s sono molto meno energetici rispetto agli
orbitali 2p puri. A prova della maggiore affinità elettronica degli
orbitali 2pz reibridati è stato calcolato che il fullerene C60
possiede una elettronegatività pari a 2,65eV e
che è in grado di ospitare sulla sua superficie fino a 12 elettroni ed
è stato sperimentalmente provato che può ospitare sulla sua
superficie fino a 2 elettroni in fase gassosa e fino a 5 elettroni in
soluzione.
convenzionali orbitali 2p. Il che è
legato al fatto che gli orbitali 2s sono molto meno energetici rispetto agli
orbitali 2p puri. A prova della maggiore affinità elettronica degli
orbitali 2pz reibridati è stato calcolato che il fullerene C60
possiede una elettronegatività pari a 2,65eV e
che è in grado di ospitare sulla sua superficie fino a 12 elettroni ed
è stato sperimentalmente provato che può ospitare sulla sua
superficie fino a 2 elettroni in fase gassosa e fino a 5 elettroni in
soluzione.
L’elevata affinità elettronica
associata ad una superficie costellata da orbitali molecolari radiali, ne fanno
un ottimo candidato come materiale per l’elettronica molecolare ed
è proprio per questa ragione che lo studio delle proprietà
chimiche e fisiche dei fullereni riveste particolare importanza nel campo della
scienza dei materiali.
Si deve infine notare come si sia venuto a
creare una sorta di paradosso: “un elemento come il carbonio che è il riducente
industriale per eccellenza, è divenuto ora un accettare di elettroni e
quindi un ossidante”
Preparazione dei
fullereni
Intorno al 1990, è stata messa a
punto una procedura per la sintesi su “grande” scala (grande
significa che una persona da sola, in una giorno di
lavoro è in grado di produrre 100g di prodotto finito) di C60.
La materia prima da cui partire è nerofumo di grafite, ottenuto
evaporando elettrodi di grafite in atmosfera satura di elio a 100Torr. Il
nerofumo viene quindi disperso in benzene (o solfuro di carbonio o tetracloruro
di carbonio). A questo punto, si lascia decantare la soluzione color rosso vino
e si allontana il solvente mediante moderato riscaldamento Il materiale solido
che si ottiene (C60) e di colore grigio scuro, può essere
sublimato più volte ed è stabile all’aria per settimane.
Una tecnica di sintesi più complessa
(coinvolge le nanotecnologie) consiste nel far evaporare della grafite
attraverso un raggio laser pulsato, mentre la susseguente formazione del
cluster è regolata da un flusso intermittente di elio. Giocando su una
sapiente alternanza laser-elio, è possibile ottenere fullereni di
dimensione voluta.
Funzionalizzazione
dei fullereni
 Prima di vedere come possono essere
funzionalizzati i fullereni, vediamo cosa si intende per funzionalizzazione di
un sistema molecolare. Per funzionalizzazione di un sistema molecolare si
intende definire un insieme di operazioni svolte dal chimico per esaltare,
rendere selettive o ampliare la gamma di proprietà già possedute
naturalmente dal sistema molecolare.
Prima di vedere come possono essere
funzionalizzati i fullereni, vediamo cosa si intende per funzionalizzazione di
un sistema molecolare. Per funzionalizzazione di un sistema molecolare si
intende definire un insieme di operazioni svolte dal chimico per esaltare,
rendere selettive o ampliare la gamma di proprietà già possedute
naturalmente dal sistema molecolare.
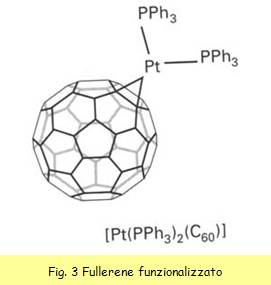
I fullereni sono stati funzionalizzati
attraverso l’inserimento sugli atomi di carbonio che ne fanno parte di
diversi gruppi funzionali, sia organici che non. Un esempio di
funzionalizzazione è mostrato in fig. 3. Tale funzionalizzazione rientra
nello spirito della metallazione del fullerene, per gli scopi che ora andremo a
descrivere.
Applicazioni dei
fullereni
I fullereni interessano il campo di studi
della scienza dei materiali per le loro proprietà metalliche,
ferromagnetiche, di conduzione e superconduzione ) conduzione in
prossimità dello zero assoluto) e, al limite di isolamento. Infatti, in base al tipo di funzionalizzazione (inorganica:
drogaggio con metalli alcalini, organica: introduzione di gruppi anionogeni),
il gap tra le bande HOMO-LUMO cambia, riducendosi nel caso più generale
(conduzione e superconduzione) o, talvolta, aumentando fino a fare del
fullerene un materiale isolante. Alla base di questi fenomeni e la
già citata affinità elettronica (conseguente, a sua volta, alla
reibridizzazione intermedia sp2-sp2), che risulta essere modulabile attraverso
funzionalizzazione e che porta i fullereni ad assomigliare ai normali
conduttori di tipo n.