Torna a ARGOMENTI DI CHIMICA FISICA
ENTROPIA ED ENERGIA LIBERA
Se un processo chimico (come una
reazione) o fisico (come un passaggio di stato) si verifica
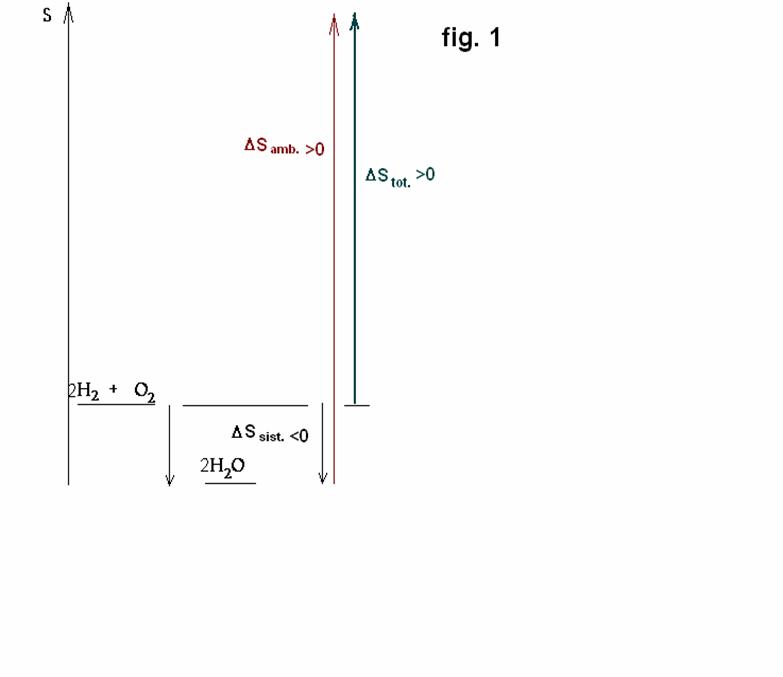
spontaneamente, in determinate condizioni di T e P, esso sarà sempre accompagnato da un aumento di entropia (ΔSto t>
0). Tale aumento è determinato
dalla somma algebrica di due contributi: la variazione di entropia
del sistema, ΔSsist.
+ la variazione
di entropia dell’ambiente ΔSamb.
Perciò se ΔSsist. + ΔSamb
= ΔStot >0, il processo sarà spontaneo.
Consideriamo, ad esempio, la reazione
di formazione dell’acqua
![]() 2H2(g) + O2(g) 2 H2O(l)
2H2(g) + O2(g) 2 H2O(l)
Dalle tabelle si ha: SoH2 = 130,6 J/°K· mol; SoO2 = 205,0 J/°K· mol; SoH2O = 188,7 J/°K· mol.
Poiché la variazione di entropia per una reazione si ricava facendo la differenza
tra la somma delle entropie molari standard dei prodotti meno la somma delle
entropie molari standard dei reagenti, ciascun valore moltiplicato per il
coefficiente stechiometrico delle corrispondente reazione chimica, abbiamo, nel
caso della formazione dell’acqua:
ΔSsist=
(2·SoH2O) -
(2· SoH2 + 1·SoO2) = 2·69,9
–(2·130,6 + 1·205,0) = -327 J/°K.
Se questo fosse l’unico risultato
della trasformazione, la formazione di acqua, che comporta
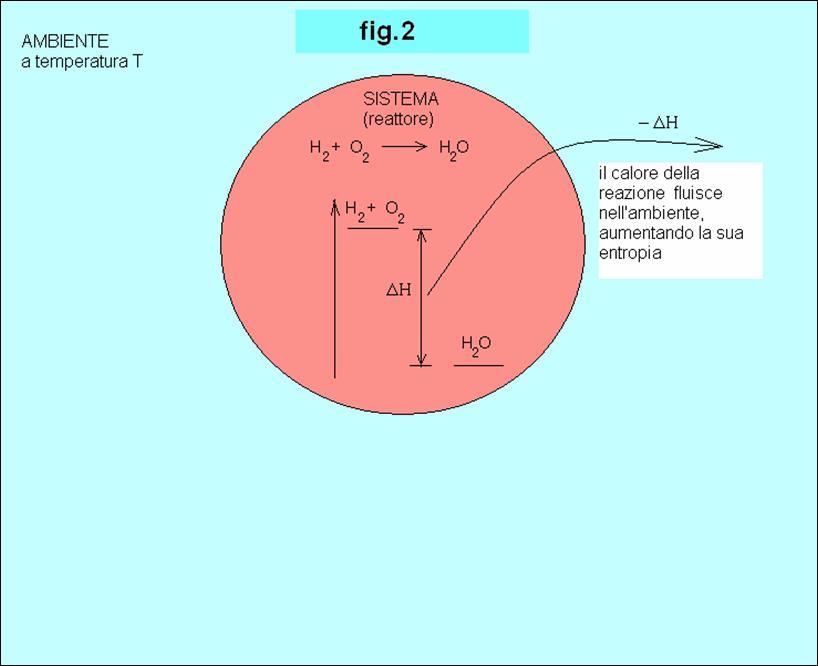
una diminuzione di entropia del sistema, non avverrebbe. D’altro canto essa è fortemente esotermica (ΔH
=-572 KJ/mol), ovvero produce 572 KJ
di energia termica per ogni mole di acqua prodotta. Poiché il sistema non è
isolato, ma può scambiare tale calore con l’ambiente esterno, quest’ultimo
acquista 572 KJ di
energia termica (cioè -ΔH = -(-572 KJ) = 572 KJ).
La sua entropia è così aumentata di  , supponendo che l’ambiente si trovi
a 298 °K (
, supponendo che l’ambiente si trovi
a 298 °K (
ΔStot = -327 J/°K
+ 1,92·103 J/°K = 1,59·103 J/°K > 0
Come si vede, la variazione globale di entropia è positiva, perciò in complesso la
formazione di acqua avviene con aumento di entropia e quindi è spontanea (vedi figure 1 e 2).
Dalla relazione ΔStot = ΔSamb + ΔSsist., esplicitando l’espressione di
 ,
,
si ha: 
Moltiplicando ambo i membri di quest’ultima per –T, si ha:
![]() (1).
(1).
Introducendo la funzione G = H –TS, chiamata ENERGIA LIBERA, la
cui variazione è ΔG
= ΔH – TΔS, si può scrivere, paragonandola con la (1) :
ΔG = -T ΔStot.
Allora possiamo osservare che una trasformazione
spontanea, che avviene con ΔStot
> 0, comporta una
variazione di energia libera negativa (ΔG < 0).
Perciò, in termini di energia libera, i processi
spontanei decorrono con una diminuzione di questa nuova grandezza di stato
termodinamica.
Il termine energia libera è dovuto anche ad un altro
aspetto importante di tale grandezza termodinamica che scaturisce dalla sua
definizione, G = H –TS. Infatti, per
una variazione infinitesima di G (a
temperatura e pressione costanti) si ottiene: dG = dH - TdS (2). Ma sappiamo anche che H =U + pV. Perciò dH =dU + pdV. Quindi la (2) diventa:
dG = dU + pdV - TdS.
Sappiamo,
inoltre, che ΔU = q + W,
dove q è il calore scambiato (per
convenzione positivo se entra nel sistema, negativo se
ne esce) e W è il lavoro prodotto
dal sistema (per convenzione negativo) o fatto sul sistema (per convenzione
positivo).
Per una trasformazione infinitesima perciò dU = dq + dW. Allora in definitiva la (2)
diventa:
dG = dq + dW + pdV - TdS. (3)
Ora
il lavoro W prodotto o fatto sul
sistema è caratterizzato da due contributi: W = W’ –pest. ·ΔV, dove W’
rappresenta le varie forme di lavoro che il sistema può produrre o subire
(energia elettrica, lavoro contro un gradiente di concentrazione, ecc.) e –pest.
·ΔV rappresenta il lavoro meccanico di espansione
o di compressione. [il segno negativo è dovuto al fatto che se il sistema si
espande durante la trasformazione, il volume finale è maggiore di quello
iniziale, determinando cosi un ΔV>0
e di conseguenza il prodotto pest.
·ΔV è >0. Ma l’espansione significa che il sistema produce lavoro
verso l’esterno, e in definitiva perde energia, perciò per convenzione esso
deve essere preceduto, come già detto, dal segno negativo. pest. indica la
pressione esterna agente sul sistema. Nel caso di trasformazioni irreversibili,
a causa della velocità con cui queste si verificano,
la pressione esterna ha un valore differente da quella interna del sistema, pest .≠ pint..
Solo nelle trasformazioni reversibili, l’estrema lentezza con cui si verificano
consente di mantenere costantemente l’eguaglianza tra la pressione esterna e
quella interna, genericamente indicata con p,
pest = pint.= p].
Per
una variazione infinitesima di W, dW, si ottiene perciò: dW = dW’ –pest. ·dV.
Introducendo questa espressione nella (3), si ha:
dG = dq + dW’ –pest. ·dV + pdV – TdS
(4)
Ma per
una trasformazione reversibile la pest.
coincide con p
. Inoltre, per una trasformazione reversibile vale la relazione
relazione
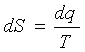
cioè
dq = T·dS.
Perciò,
in conclusione, nel caso di trasformazioni reversibili la (4) si riduce a:
dG = dq + dW’ –pest. ·dV + pdV – TdS = dW’
ovvero, per una trasformazione finita: ΔG = W’ , che si enuncia come segue:
In una
trasformazione reversibile, a temperatura e pressione costanti, la variazione di energia libera è uguale in valore assoluto e segno al
lavoro prodotto nella trasformazione.
Essa rappresenta il massimo lavoro ottenibile: infatti il lavoro prodotto in una trasformazione
irreversibile condotta tra gli stessi estremi di una trasformazione reversibile
sarà sempre inferiore a W’.
L’ENERGIA
LIBERA DI REAZIONE
E’ la variazione di energia
libera che accompagna lo svolgimento di una reazione chimica.
In
particolare, l’energia libera standard di reazione è la variazione di energia libera in una reazione in cui i reagenti e i
prodotti sono nel loro stato standard.
Essa si può calcolare dall’entalpia standard e
dall’entropia standard, utilizzando le tavole dell’entalpia di formazione ΔHO e dell’entropia
assoluta delle sostanze
ΔSO:
ΔGO = ΔHO - T·ΔSO
Così
come si definisce l’entalpia standard di formazione di un composto a partire dai suoi elementi nello stato standard, nello stesso
modo si definisce l’energia libera
standard di formazione di un composto come la variazione di energia
libera nella reazione di formazione del composto a partire dai suoi elementi
nello stato standard.
Torna a ARGOMENTI DI CHIMICA FISICA