Torna a ARGOMENTI DI CHIMICA FISICA
ENERGIA LIBERA ED EQUILIBRIO CHIMICO
NELLE REAZIONI IN FASE GASSOSA
![]()
Da una delle equazioni fondamentali
che esprimono i differenziali delle funzioni termodinamiche
![]()
Si
ricava, per un processo infinitesimo che avviene a temperatura costante,
![]() (1)
(1)
Ma, essendo per la legge di
stato dei gas ideali,
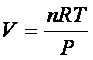
la (1) diventa
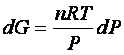
o anche
![]() (
(
La variazione di energia
libera in una trasformazione finita tra gli estremi G0e P0,
che rappresentano l’energia libera e la pressione in uno stato standard
opportunamente scelto e i corrispondenti valori in qualunque altro stato G e P
è ottenuta integrando ambo i membri
della (
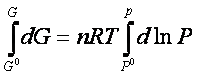
Da cui si ottiene:.
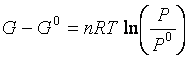 (2)
(2)
Poiché per la pressione si è
scelto come stato standard il valore P0 = 1atm, l’equazione (2) diventa:
![]() (3)
(3)
Questa
equazione indica la variazione di energia libera che un gas subisce nel
passaggio dalla pressione di 1 atm nello
stato standard , al valore generico P finale.
Ora se consideriamo una
miscela di gas, ciascuno dei quali possiede una pressione parziale pi, la (3) può essere applicata ad ogni componente iesimo della miscela: .
![]()
![]()
![]() Consideriamo una reazione in fase gassosa: νa A + νb B νc C +
νd D
Consideriamo una reazione in fase gassosa: νa A + νb B νc C +
νd D
La variazione ΔG che accompagna questa
reazione è
![]() (4)
(4)
dove ΔGi sono
le variazioni delle energie libere dei gas e i coefficienti stechiometrici υ dei reagenti sono presi col
segno negativo.
Sapendo però che la
variazione di energia libera di ogni componente gassoso è data dalla (3), la (4) può essere scritta nel seguente modo:
![]() (
(
Se la reazione giunge
all’equilibrio, ΔG =0, perciò la (3) diventa:
![]() ,
,
cioè:
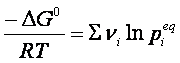 (5)
(5)
Nella quale si vede che a
temperatura costante, il primo membro deve essere costante, essendo ΔG0
indipendente dalla temperatura. Perciò lo sarà anche il secondo membro
dell’espressione, che, per la proprietà dei logaritmi, può essere scritto nel seguente modo:
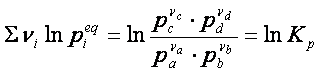
Dove Kp è la costante di equilibrio in funzione delle pressioni
parziali dei componenti gassosi. In definitiva la (5) diventa:
![]()
Se
è nota la variazione di energia libera standard della reazione, passando dai
logaritmi ai numeri si ottiene il valore della costante di equilibrio in
funzione delle pressioni parziali della
reazione
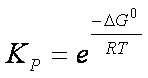
Torna a ARGOMENTI DI CHIMICA FISICA