Torna a ARGOMENTI DI CHIMICA ORGANICA
LE
PRINCIPALI REAZIONI DI ADDIZIONE NUCLEOFILA AL GRUPPO CARBONILICO DELLE ALDEIDI
E DEI CHETONI
a)
Struttura del gruppo carbonilico.
Il gruppo carbonilico è altamente polare a
causa della differenza di elettronegatività tra l’ossigeno (più
elettronegativo) e il carbonio. Inoltre , per la presenza del doppio legame tra
ossigeno e carbonio, il gruppo carbonilico è un ibrido di risonanza tra due
formule limiti:
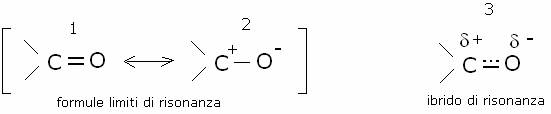
La
formula limite
Una
dimostrazione dell’alta polarità del gruppo carbonilico è l’elevato momento di
dipolo elettrico, pari a 2,7 Debye, che corrisponde a circa il 40-50% di
carattere ionico. Le proprietà fisiche delle aldeidi e dei chetoni sono
influenzate dalla struttura del gruppo carbonilico. Infatti la temperatura di
ebollizione dei composti carbonilici è superiore a quella degli idrocarburi di
identico peso molecolare e la solubilità delle aldeidi e dei chetoni con basso
peso molecolare nei solventi polari come
l’acqua è molto elevata, a causa della formazione dei forti legami ad idrogeno.
La struttura del gruppo carbonilico,
inoltre, è responsabile della reattività
delle aldeidi e dei chetoni e spiega
l’attacco di varie specie di nucleofili al carbonio carbonilico parzialmente
positivo, con l’addizione finale delle molecole reagenti. Pertanto la reazione
fondamentale dei composti carbonilici è la reazione
di addizione nucleofila, il cui meccanismo generale è il seguente:
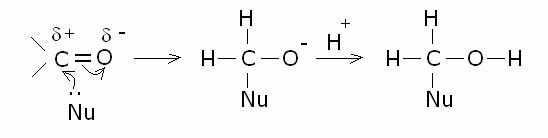
La
reattività dei composti carbonilici riguardo alla reazione di addizione
nucleofila segue il seguente ordine:
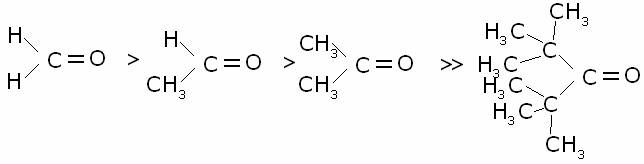
come
si vede, essa diminuisce con l’aumento dell’ingombro sterico in vicinanza del
gruppo carbonilico.
b)
Le reazioni di addizione nucleofila più importanti.
1)
addizione di acido cianidrico.
La reazione avviene in ambiente basico
attraverso i seguenti stadi:
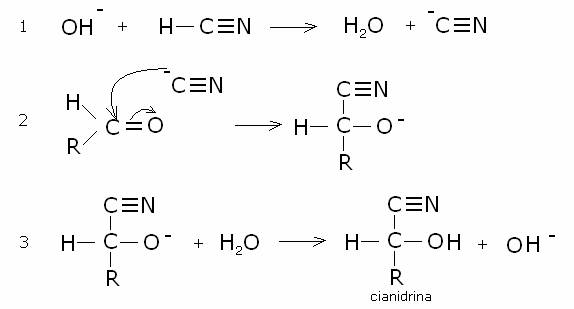
2)
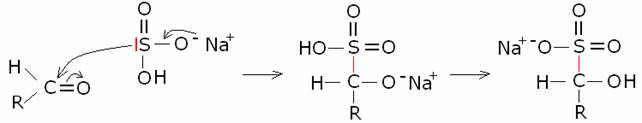
Addizione
di bisolfito.
Avviene in soluzione acquosa con la
maggiorparte delle aldeidi, metilchetoni
e
chetoni ciclici con scarso
ingombro sterico attorno al gruppo carbonilico.
Meccanismo di reazione
Es.:
3)
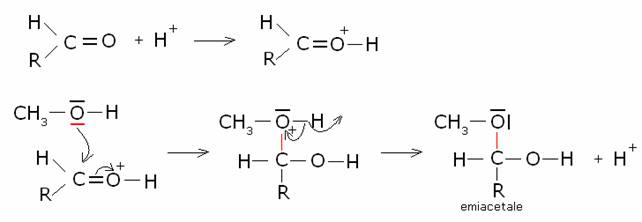
Addizione di alcoli: formazione di emiacetali ed
acetali.
Meccanismo di reazione:
· Catalisi acida:
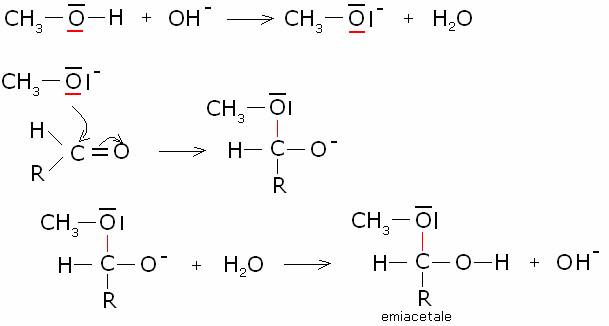
· Catalisi basica:
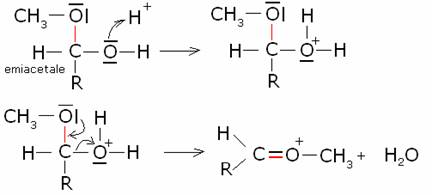
L’emiacetale può essere trasformato in acetale
per reazione con una seconda molecola di alcole. In questo caso la
trasformazione in acetale è catalizzata solo da acidi:
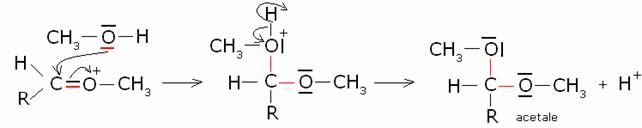
4)
Condensazione dei composti carbonilici con derivati di
formula generale RNH2.
Una grande varietà di sostanze con
gruppi –NH2 reagiscono con i
composti carbonilici per dare composti
del tipo e
acqua.
La
reazione richiede catalizzatori acidi. Il pH della soluzione in cui avviene la
condensazione non deve essere però molto basso. Infatti, se è vero che una
elevata acidità aumenta la concentrazione di composto carbonilico protonato,
più disponibile all’attacco del nucleofilo, è anche vero che nel contempo, a
causa della natura basica dell’ammoniaca e della ammine, avviene la
protonazione di queste e la conseguente perdita della loro nucleofilicità.
Bisogna perciò raggiungere un compromesso, che si ottiene tamponando il pH del
sistema di reazione a al valore ottimale di circa 4-4,5.. Il meccanismo
generale della reazione è il seguente:
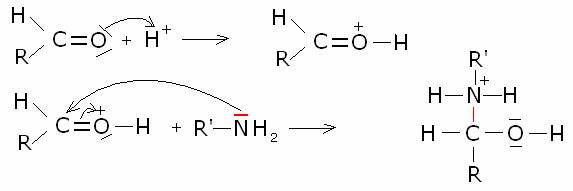
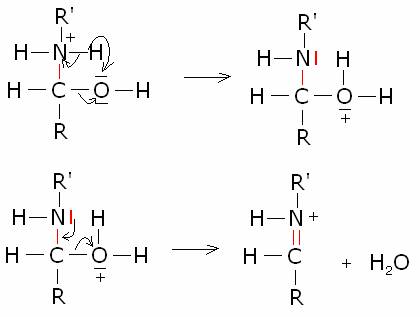
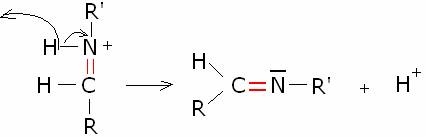
Molti composti azotati,
caratterizzati da diversi tipi di gruppi, indicati genericamente con R’,
possono reagire con un composto carbonilico, dando luogo ad una molteplice
varietà di composti
azotati.
Nella tabella qui sotto sono
riportati alcuni reagenti azotati e le
classi di composti a cui danno luogo per reazione con i composti carbonilici.
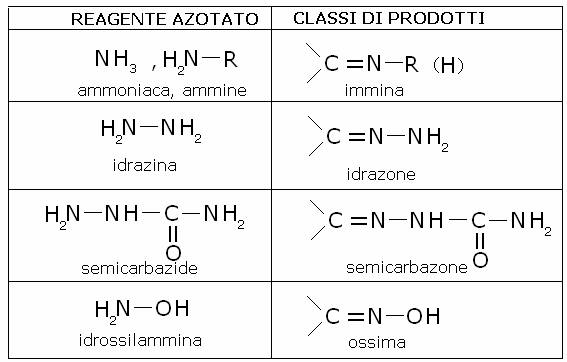
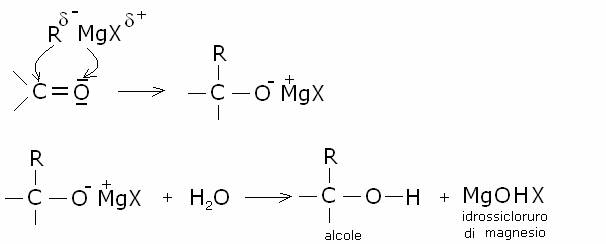
5)
Addizione dei
reattivi di Grignard
I reattivi di Grignard si sommano velocemente
al doppio legame carbonilico, portando alla formazione di alcoli:
Torna a ARGOMENTI DI CHIMICA ORGANICA