Torna a ARGOMENTI DI CHIMICA ORGANICA
CARBOIDRATI
MONOSACCARIDI
Hanno
formula bruta (CH2O)n.
Sono costituiti da una catena lineare di atomi di carbonio, con un minimo di
tre e prendono il nome di triosi, tetrosi, pentosi, esosi, ecc., a seconda del numero di atomi di carbonio
presenti nella molecola. Sono poliidrossialdeidi
o poliidrossichetoni aventi
generalmente un gruppo ossidrile per ogni atomo di carbonio della catena,
tranne uno, carbonilico. Si distinguono in aldosi
e in chetosi a seconda che il gruppo
carbonilico sia rispettivamente all’inizio della catena o all’interno della
stessa. Gli atomi di carbonio interni della catena sono glucosi, poiché legati
a quattro gruppi differenti, perciò si possono avere 2n stereoisomeri, dove n è il numero di atomi di
carbonio asimmetrici.
I
monosaccaridi che interessano sono quelli formalmente derivati dalla D-gliceraldeide, aldotrioso. Tutti
hanno il penultimo atomo di carbonio della catena (ultimo asimmetrico) col
gruppo ossidrile alla destra (D), disponendo la catena col gruppo carbonilico
il alto. Nella tabella sottostante sono riportati i carboidrati aldotriosi,
aldotetrosi, aldopentosi e aldoesosi della serie D, col relativo nome:

Sebbene
i monosaccaridi vengano rappresentati come catene lineari, essi esistono
prevalentemente sottoforma di due composti ciclici, in equilibrio tra loro e
con la catena aperta:

Due
diastereoisomeri come l’a e il b glucosio vengono chiamati anomeri, mentre due diastereoisomeri
che differiscono solo per un solo qualsiasi altro centro glucosi si chiamano epimeri.
Dalla
figura si nota che entrambi gli anomeri del glucosio sono nella conformazione a
sedia, più stabile, e che l’anomero beta ha tutti i sostituenti in posizione
equatoriale, mentre l’ossidrile nella posizione 1 dell’anomero alfa è in
posizione assiale. L’anomero beta è quindi un po’ più stabile di quello alfa,
come si nota dalle percentuali delle due forme in equilibrio. Molto spesso, per
semplicità e praticità si ricorre ad una rappresentazione semplificata
dell’anello, utilizzando le proiezioni
di Haworth, in cui l’anello è rappresentato come se fosse su un piano e in prospettiva: i sostituenti che nella forma lineare aperta si
trovano a destra (con il gruppo carbonilico in altro) vengono a trovarsi sotto
il piano, quelli a sinistra vengono a trovarsi sopra il piano.
Per
trasformare una formula a catena aperta nella proiezione di Haworth occorre:
1) fare una rotazione di 90° in senso orario, in modo che
la catena risulti orizzontale, col gruppo carbonilico a destra;
2) ripiegare la catena in modo che risulti simile ad un
esagono;
3) ruotare i tre gruppi attorno al legame tra gli atomi
di carbonio 4 e
a) Mutarotazione.
Come illustrato
dalla figura in alto nella pagina esiste un equilibrio tra le forme
emiacetaliche a- e b- e la forma
aperta del glucosio. Ciò è evidenziato dalle misure del potere rotatorio. L’ a-glucosio e b-glucosio sono diastereoisomeri,
hanno proprietà chimiche e fisiche differenti e possono essere ottenuti allo
stato puro. Quando l’
a-glucosio e b-glucosio puri vengono sciolti in acqua, il potere rotatorio delle due
soluzioni è inizialmente diverso e corrisponde a [a]D20= +112,2° per la soluzione dell’ a-glucosio e a [a]D20= +18,7° per la soluzione
del b-glucosio. Col passare del tempo entrambe le soluzioni
mostrano una variazione del potere rotatorio, finchè viene raggiunto in entrambi i casi un valore di
equilibrio corrispondente a [a]D20=
+52,7°. Questa variazione del potere rotatorio, detta mutarotazione, è dovuta all’esistenza di un equilibrio tra le forme
a-, b- e quella lineare, per cui i due anomeri puri
si trasformano nella stessa miscela di equilibrio, contenente circa il 36% di
forma a-, circa il 64% di forma b- e meno dell’1% della forma aperta.
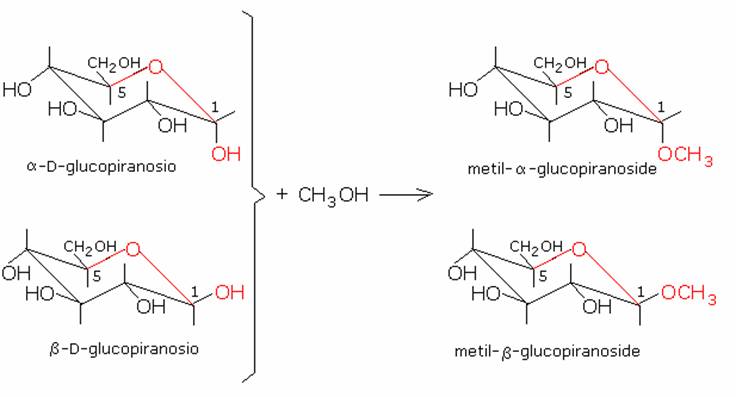
b) Glicosidi.
Gli
zuccheri reagiscono facilmente con gli alcoli in presenza di acidi minerali,
formando degli acetali detti glicosidi.
Se si tiene presente che i monosaccaridi sono degli emiacetali, si capisce che
questa reazione è la normale trasformazione di un’aldeide o di un chetone
rispettivamente in acetale e in chetale per ulteriore reazione con un alcole.
Nel caso degli zuccheri si possono fromare sia a- glucosidi che b-glicosidi, a seconda che il legame glicosidico sia orientato
sopra o sotto il piano dell’anello. La parte alcolica è chiamata aglicone. In generale quindi anche i
disaccaridi e i polisaccaridi sono glicosidi.
REAZIONI DEI MONOSACCARIDI
1) Reazioni con
acidi e basi.
I
monosaccaridi sono stabili nei confronti degli acidi minerali diluiti, mentre
in presenza di acidi minerali concentrati a caldo si hanno delle reazioni di
disidratazione con formazione di composti ciclici detti furfurali:

Le
basi diluite a freddo provocano la isomerizzazione della posizione adiacente a
quella carbonilica mediante passaggio attraverso la forma enolica, che è comune
agli isomeri che differiscono solo per la configurazione del carbonio adiacente
al gruppo carbonilico. Sono possibili inoltre delle isomerizzazioni
aldoso-chetoso, tra un aldoso e un chetoso che abbiano in comune la forma
enolica. Così il D-glucosio si trasforma in una miscela di equilibrio di D-glucosio, D-mannosio, D-fruttosio, i
quali hanno la stessa forma enolica, detta endiolo:

2) Reazioni di
ossidazione. Saggi di Benedict, Feeling e di Tollens.
I reagenti di Benedict e di Feeling,
costituiti da una soluzione alcalina di ioni Cu++, e il reagente di
Tollens, costituito da una soluzione di ioni [Ag(NH3)2]+,
ossidano le aldeidi e gli a-idrossichetoni.
Questi
reagenti vengono utilizzati a scopo analitico per individuare la presenza di
zuccheri: essi danno reazione positiva con quegli zuccheri, detti zuccheri riducenti, che hanno un gruppo
emiacetalico o emichetalico:

3) Ossidazione
con acqua di Bromo.
Il bromo in soluzione acquosa è un
blando ossidante che ossida selettivamente il gruppo aldeidico a gruppo carbossilico,
trasformando gli aldosi in acidi aldonici, che possono
trasformarsi in g-lattoni. Es:

4) Ossidazione
con acido nitrico.
L’acido
nitrico ossida sia il gruppo aldeidico che il gruppo alcolico terminale a
gruppi carbossilici. Questi acidi bicarbossilici vengono chiamati acidi aldarici.

5) Ossidazione
con acido periodico.
Il meccanismo di reazione di questa ossidazione è
stato esaminato dettagliatamente nel capitolo dei composti carbonilici, in
particolare nella sezione della sintesi delle aldeidi a partire dai dioli
vicinali. Essendo i carboidrati dei poli-oli, l’acido periodico ossida tali
composti, frammentadoli in molecole di acido formico e di formaldeide. La
reazione avviene in acqua, dove il gruppo carbonilico del carboidrato deve
essere idratato per dare inizio alla scissione. Illustriamo, come esempio,
l’ossidazione del glucosio:
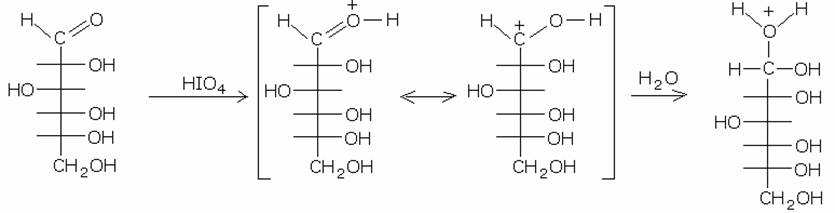

Come si vede il gruppo aldeidico viene“tagliato” dalla
molecola, formando una molecola di acido formico. la nuova molecola di
carboidrato presenta un carbonio in meno e un nouvo gruppo aldeidico. L’acido
periodico, con le stesse modalità, attacca la nuova catena, riducendola di volta
in volta di una unità, con la formazione, ogni volta, di acido formico. Il
carbonio terminale, infine, viene ossidato a formaldeide. Pertanto dalla
molecola di glucosio alla fine della reazione
si formeranno 5 molecole di acido formico e 1 di formaldeide.
6) Riduzione
degli zuccheri. Alditoli.
La
riduzione degli zuccheri con NaBH4 o altri riducenti come H2
/Pt porta alla formazione di composti poliossidrilici, detti alditoli, come il D-glucitolo dal
D-glucosio, o il D-mannitolo dal D-mannosio:

7) Reazione con
fenilidrazina. Osazoni.
I monosaccaridi reagiscono con la fenilidrazina formando un bis-fenilidrazone , chiamato osazone. In questa reazione vengono
consumate tre moli di fenilidrazina per
ogni mole di monosaccaride: una serve per formare normalmente il
fenilidrazone, la seconda molecola di fenilidrazina ossida il gruppo alcolico
adiacente al gruppo carbonilico, trasformandolo in un nuovo gruppo carbonilico
e riducendosi ad anilina e ammoniaca, la terza forma col nuovo gruppo
carbonilico il secondo gruppo fenilidrazonico:

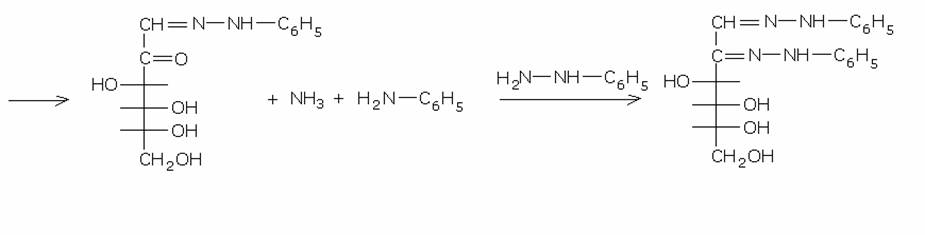
La
formazione dell’ossazone elimina la chiralità del carbonio C-2, per cui due
monosaccaridi differenti solo per la chiralità al C-2 danno lo stesso ossazone
. Cosi, ad esempio, D-glucosio e D-mannosio danno lo stesso ossazone. Questa proprietà è stata ampiamente
sfruttata per la determinazione della struttura di molti saccaridi.
Deosssizuccheri
Alcuni
zuccheri mancano di un gruppo alcolico, per cui sono chiamati desossizuccheri..
Tra essi una grande importanza riveste il 2-desossi-D-ribosio,
costituente del DNA:

Amminozuccheri
Negli
amminozuccheri un gruppo amminico sostituisce un gruppo ossidrilico.

Disaccaridi
Sono
costituiti da due monosaccaridi uniti insieme da un legame glucosidico. La
maggiorparte dei disaccaridi è riducente:
in questi disaccaridi il legame glucosidico impegna l’ossidrile semiacetalico
della prima molecola di monosaccaride e un ossidrile della seconda molecola,
generalmente quello in posizione 4. Rimane in tal modo libero il gruppo
carbonilico della seconda molecola di monosaccaride in forma emiacetalica, il
che conferisce all’intera molecola proprietà riducenti. I più importanti
disaccaridi sono il maltosio, il cellobiosio, il lattosio,
tutti riducenti e Il saccarosio, non riducente:



.
Polisaccaridi
I
principali tipi di polisaccaridi sono:
a)
Cellulosa: è un polimero del b-D-glucosio.
Le unità monomeriche sono unite da legami glucosidici tra l’ossidrile
emiacetalico di una molecola e l’ossidrile in posizione 4 della molecola
successiva.
b)
Amido: è un polimero dell’a-D-glucosio. Nell’amido sono presenti due polisaccaridi, l’amilosio e l’amilopectina, entrambi polimeri dell’ a-D-glucosio.
c) Glicogeno:
è un polimero dell’ a-D-glucosio con legami glucosidici tra le posizioni
l’ossidrile emiacetalico di una molecola e l’ossidrile in posizione 6 della
molecola successiva.
Torna a ARGOMENTI DI CHIMICA ORGANICA