Torna a ARGOMENTI DI CHIMICA ORGANICA
LE AMMINE
Sono
composti formalmente derivati dall’ammoniaca per sostituzione di uno o più atomi
di idrogeno con gruppi alchilici. A seconda del numero di gruppi alchilici
legati all’atomo di azoto, le ammine si distinguono in primarie, secondarie,
terziarie e sali di ammonio quaternari. Presentano temperature di ebollizione
più elevate di quelle relative agli alcani di uguale peso molecolare a causa
dei legami ad idrogeno intermolecolari che si stabiliscono tra atomi di
idrogeno che in una molecola sono legati all’atomo di azoto e atomi di azoto di
un’altra molecola. Grazie alla polarizzazione dei gruppi amminici, e alla
possibilità di formare legami ad idrogeno, le ammine di basso peso molecolare
sono solubili nei solventi polari, ma la solubilità diminuisce rapidamente
all’aumentare della lunghezza delle catene idrocarburiche legate all’azoto.
STEREOCHIMICA DELLE AMMINE
L’azoto
amminico presenta un’ibridizzazione tetraedrica a causa dell’ibridazione di
tipo sp3. A tre dei quattro vertici del tetraedro sono legati i
gruppi legati all’azoto (gruppi alchilici o atomi di idrogeno), nel quarto vertice
risiede il doppietto elettronico non condiviso dell’azoto. Se l’ammina è
terziaria e i gruppi alchilici sono differenti fra loro, l’azoto amminico è
asimmetrico e la molecola dovrebbe presentare isomeria ottica:
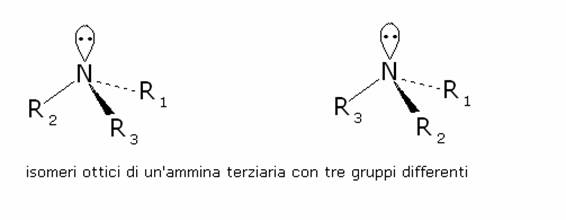
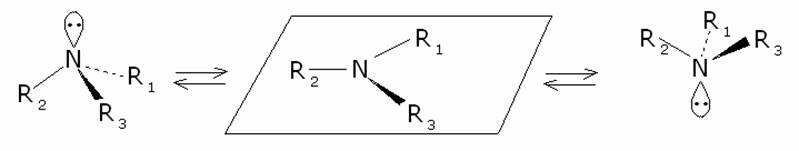
Non
è comunque possibile risolvere miscele di tali isomeri ottici. Il motivo
risiede nella elevata velocità di interconversione dei due isomeri, 103,
105 interconversioni al secondo. Tale rapidità impedisce la
risoluzione degli isomeri ottici con le attuali tecniche disponibili:
AMMINE COME ACIDI E BASI
Le
ammine alifatiche sono acidi debolissimi, con Ka dell’ordine di 10-33.
La donazione di un protone avviene quindi solo in presenza di basi fortissime,
come il trifenil litio:
![]()
Le
ammine alifatiche anche sono le basi organiche più forti, con valori di Kb
compresi tra 10-4e 10-5.
La
forza basica segue l’ordine: ammine terziarie > ammine secondarie >
ammine primarie > ammoniaca. Il motivo sta nel fatto che i gruppi alchilici
sono elettrondatori per effetto induttivo (+I) e, di conseguenza, le ammine
terziarie, nelle quali l’azoto e legato a tre gruppi alchilici, sopportano
meglio la carica positiva che si manifesta sull’atomo di azoto dopo
l’acquisizione del protone:
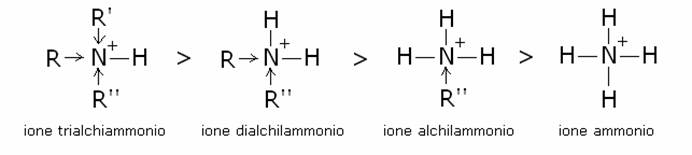
La
basicità delle ammine aromatiche è decisamente inferiore a quella delle ammine
alifatiche. La piridina presenta una Kb
= 1,7·10-9. La causa della minore basicità è dovuta al fatto
che nella piridina, a causa dell’ibridazione sp2 dell’atomo di
azoto, il doppietto di elettroni da condividere col protone si trovano più
vicini al nucleo, sono quindi più tenacemente attratti da questo e sono perciò
meno disponibili per la donazione:
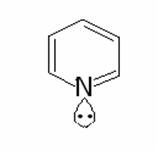
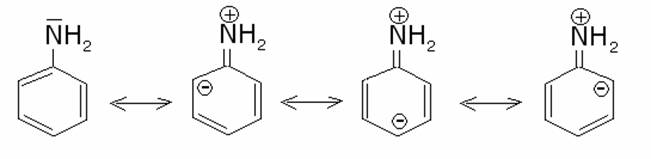
Per
l’anilina, un’altra ammina aromatica
(ammina primaria), che presenta una Kb
= 3,8·10-10, il basso
valore di basicità, come si vede dalle formule limiti di risonanza, è causato
dall’alto grado di donazione del doppietto dell’azoto all’anello benzenico (3
formule limiti su 4):
METODI DI PREPARAZIONE DELLE AMMINE
1) Alchilazione
dell’ammoniaca.
Gli alogenuri alchilici possono reagire con l’azoto
amminico, nucleofilo, formando sali di alchilammonio:
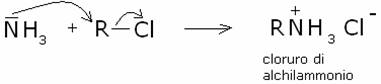
E’ una reazione di sostituzione nucleofila. Per questa
sintesi è necessario utilizzare alogenuri alchilici la cui struttura li rende
più reattivi verso la sostituzione nucleofila (di tipo SN2), più che verso
l’eliminazione (E2) (che invece porterebbe ad un alchene invece che ad
un’ammina). Il sale di ammonio, formatosi nel primo passaggio, viene trattato
con idrossido di sodio per liberare l’ammina:
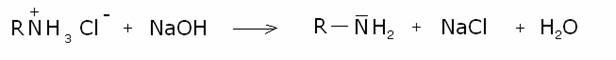
Questo metodo di sintesi ha il grosso limite di
produrre una miscela di ammine primarie, secondarie e terziarie e di sali di tetralchilammonio.
Infatti in ogni passaggio, dopo il trattamento con l’idrossido di sodio viene
ripristinato il doppietto elettronico sull’azoto, che così riacquista la
capacità nucleofila e reagisce con un’altra molecola di alogenuro, fino alla
formazione di un sale quaternario di ammonio:
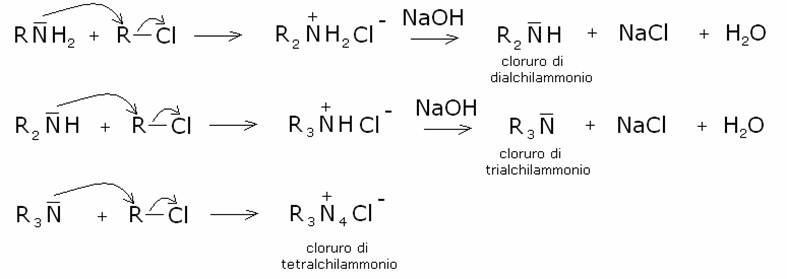
2) Alchilazione
dell’ammoniaca con alcoli primari.
Le ammine possono essere preparate anche per
alchilazione con alcoli primari, ad alte temperature e pressioni, con catalizzatori
acidi. E’ una reazione di tipo SN2, con attacco dell’ammoniaca al sale di
ossonio dell’alcole:
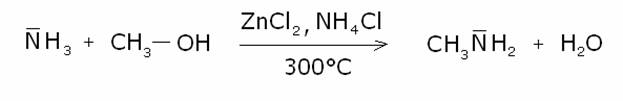
Meccanismo:
Es. :
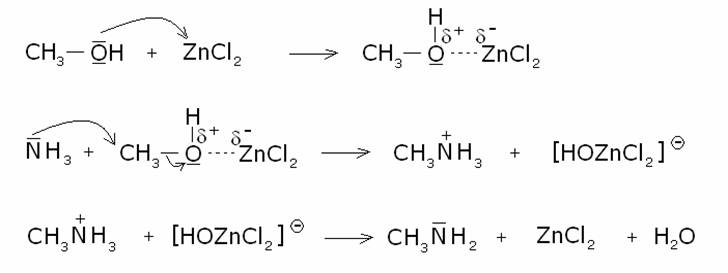
Comunque anche in questo caso si formano miscele di
ammine variamente sostituite.
3) Sintesi di Gabriel.
La sintesi di Gabriel è stata già discussa
in dettaglio nella sezione “DERIVATI DEGLI ACIDI DICARBOSSILICI”, a cui si
rimanda.
4) Reazione di
Ritter.
Per la preparazione di ammine primarie con il radicale alchilico terziario è utile la
sintesi di Ritter, che utilizza un nitrile o dall’acido cianidrico. Si parte da
un alcole o da un alchene, per ottenere un carbocatione, il quale viene poi
fatto reagire col nitrile o con l’acido cianidrico:
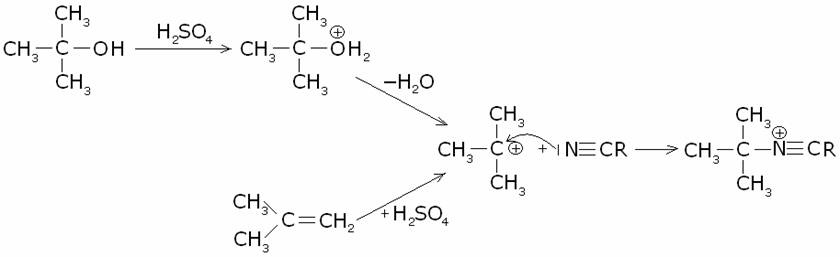
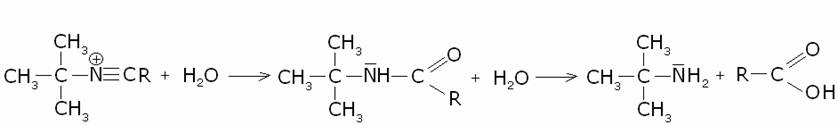
5) Degradazione
di Hofmann delle ammidi.
E’ un metodo
per la sintesi delle ammine primarie. La reazione globale di preparazione è:
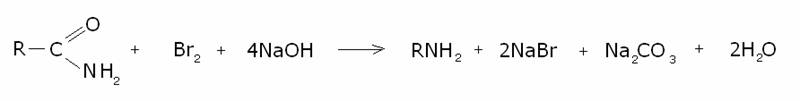
Meccanismo:
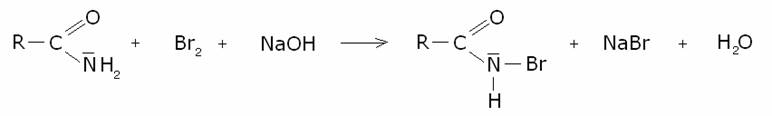
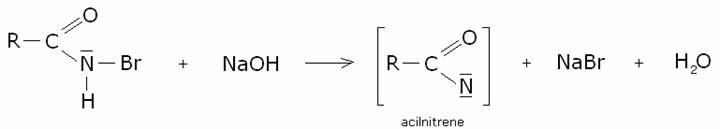
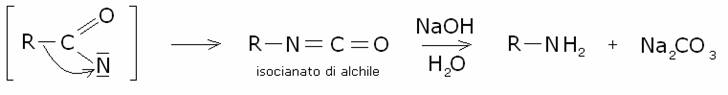
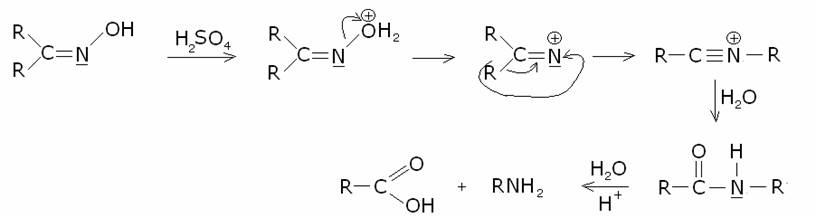
6) Trasposizione
di Beckmann.
In
questa sintesi si parte da un’ossima in ambiente acido per acido solforico:
7) Formazione
di ammine per riduzione dei nitrocomposti.
Le
ammine primarie si possono ottenere per riduzione dei nitrocomposti . La forte
esotermicità di queste reazioni richiede molta attenzione:
![]()
Le ammine si possono ottenere molto facilmente e con
ottima resa dalla riduzione, con
tetraidruro di litio e alluminio, delle ammidi non sostituite, delle ammidi monosostituite, delle ammidi
disostituite, con formazione rispettivamente di ammine primarie, secondarie
e terziarie. La reazione è stata già trattata nella sezione dei derivati
funzionali degli acidi carbossilici.
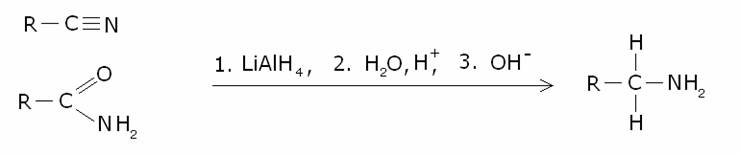
8) Formazione
di ammine per riduzione dei nitrili e delle ammidi con tetraidruro di litio e
di alluminio.
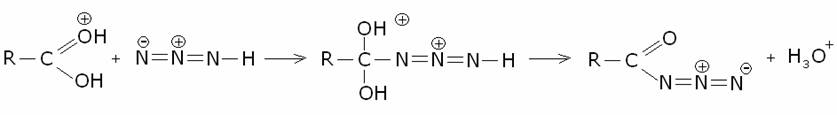
9) Degradazione
di Schmidt delle acilazidi.
Si
parte da una soluzione di acido carbossilico in acido solforico concentrato
(viene protonato l’ossigeno carbonilico) alla quale si aggiunge l’acido azoico
in soluzione cloroformica. Si forma una acilazide:
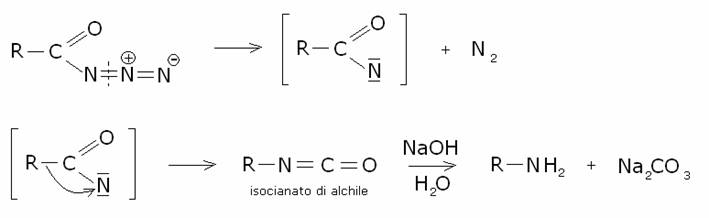
Quest’ultima perede azoto,
formando l’acilnitrene come intermedio, il quale subisce la stessa
trasformazione illustrata nella degradazione di Hofmann:
REAZIONI DELLE AMMINE
1) Formazione
di Sali.
L’azoto
amminico possiede un doppietto elettronico non condiviso che, in presenza di un
acido, può essere protonato, portando alla formazione di Sali di ammonio. (vedi
pag.1)
2) Acilazione
delle ammine.
Questa reazione è stata già trattata nella
sezione dei derivati funzionali degli acidi carbossilici.
3) Reazione
delle ammine con acido nitroso.
Una delle più importanti e interessanti
reazioni delle ammine è quella con acido
nitroso. La natura dei prodotti dipende strettamente dalla natura dell’ammina
(primaria, secondaria o terziaria). Inoltre, proprio per questo, la reazione
con acido nitroso è usata per stabilire la natura dell’ammina. Infatti, mentre
le ammine primarie evolvono, per reazione con acido nitroso, l’azoto
molecolare, quelle secondarie danno N-nitroso composti, gialli, liquidi o
solidi, insolubili, mentre quelle terziarie danno usualmente composti
complessi.
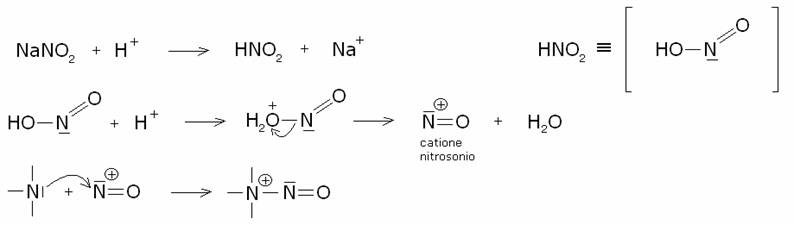
L’acido nitroso è molto instabile e deve essere
preparato al momento, usualmente miscelando una soluzione di nitrito di sodio e
di acido cloridrico a
Il meccanismo della reazione prevede innanzitutto
l’addizione dello ione nitrosonio all’azoto amminico:
Da questo punto in poi il prodotto che si
forma dipende dal tipo di ammina:
a) Ammina
primaria:
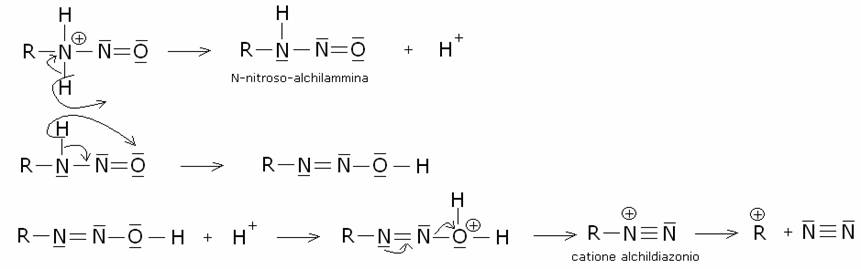
Il
carbocatione alchilico prodotto può reagire in un’ampia varietà di reazioni.
Nell’esempio R+ = carbocatione etile:
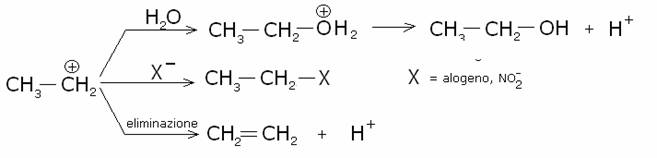
b) Ammina
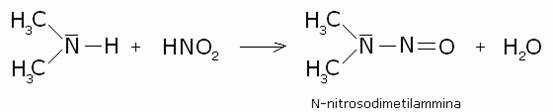
secondaria:
Il catione intermedio dell’ammina secondaria perde un
protone, producendo una N- nitrosammina:
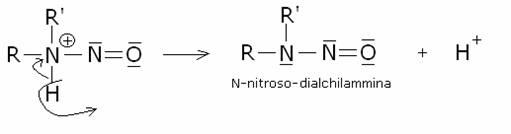
Le N-nitrosammine sono composti di colore giallo o
giallo-arancione, insolubili in acqua.
c) Ammina
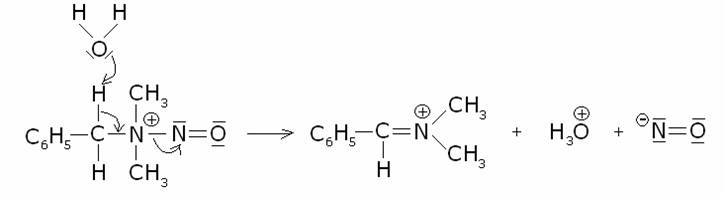
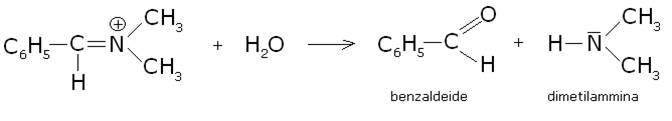
terziaria:
Con le ammine
terziarie si verifica una complessa sequenza di reazioni che portano alla
formazione di un’aldeide. Meccanismo (la benzildimetilammina come esempio):
4) Alogenazione
delle ammine.
Le ammine
primarie in presenza di ipoclorito in soluzione alcalina danno luogo a mono- e
di-N-alogeno ammine. Quelle secondarie danno luogo a mono N-alogeno ammine.
Sono composti poco stabili e vengono usati come agenti ossidanti:

OSSIDAZIONE DELLE AMMINE
Le
ammine possono essere ossidate da perossido di idrogeno (acqua ossigenata) o da
perossidi organici (come i perossiacidi).
Le
ammine primarie e secondarie sono ossidate
rispettivamente a N-alchilidrossilammine e a N,N-dialchilidrossilammine:
Le
idrossilammine composti facilmente ossidabili. Inoltre l’ossidazione per le
ammine primarie può spingersi fino alla formazione di nitrocomposti.
Le
ammine terziarie, per ossidazione
danno luogo ai trialchilammino ossidi. Es.:
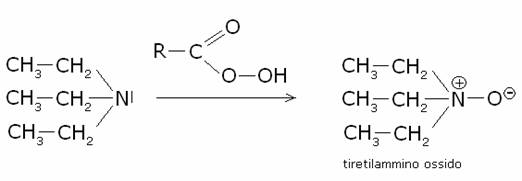
Gli
ammino ossidi, nel caso in cui i tre gruppi alchilici legati all’azoto siano
differenti si possono risolvere in due
forme otticamente attive, per l’impossibilità dell’azoto quaternario di
sottostare all’inversione della configurazione.
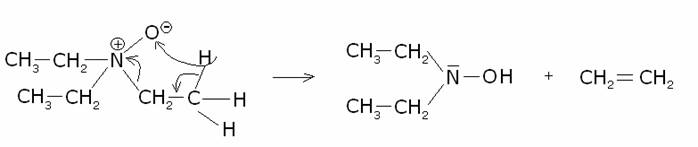
Inoltre
vi è una interessante proprietà degli ammino ossidi ternari: per forte
riscaldamento queste sostanze si decompongono, dando luogo ad un alchene e a
un’drossilammina secondaria. Questo comportamento al riscaldamento è utilizzato
come utile metodo di preparazione degli alcheni:
Torna a ARGOMENTI DI CHIMICA ORGANICA