L'anidrasi
carbonica è un enzima che catalizza la rapida interconversione
di anidride carbonica e acqua in acido carbonico, protoni e ioni
bicarbonato.
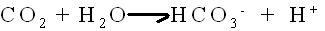
Da
allora, è stato trovato in abbondanza in tutti i tessuti dei
mammiferi, ma anche in piante, alghe e batteri. Questo è un
enzima antico e se ne conoscono tre classi distinte (chiamate anidrasi
carbonica alfa, beta e gamma). I membri delle diverse classi hanno in
comune molto poco della loro sequenza e della loro struttura, anche se
svolgono tutti la stessa funzione e richiedono un ione zinco nel loro
sito attivo. Le anidrasi carboniche dei mammiferi appartengono alla
classe alfa, gli enzimi delle piante appartengono alla classe beta,
mentre l'enzima dei batteri produttori di metano che vivono sul fondo
delle paludi appartiene alla classe gamma. Appare evidente che queste
classi di enzimi si sono evolute indipendentemente e hanno creato dei
siti attivi enzimatici simili.
Le Anidrasi carboniche dei mammiferi si presentano in circa 10 forme lievemente diverse a seconda del tessuto o del tipo di cellule in cui sono localizzate. Questi isozimi hanno alcune variazioni di sequenza che conducono a specifiche differenze nella loro attività. Gli isozimi trovati nelle fibre muscolari hanno una bassa attività enzimatica se paragonati a quelli secreti dalle ghiandole salivari. Mentre la maggior parte degli isozimi di anidrasi carbonica è solubile e viene secreta, alcuni sono legati alle membrane di specifiche cellule epiteliari.
Le Anidrasi carboniche dei mammiferi si presentano in circa 10 forme lievemente diverse a seconda del tessuto o del tipo di cellule in cui sono localizzate. Questi isozimi hanno alcune variazioni di sequenza che conducono a specifiche differenze nella loro attività. Gli isozimi trovati nelle fibre muscolari hanno una bassa attività enzimatica se paragonati a quelli secreti dalle ghiandole salivari. Mentre la maggior parte degli isozimi di anidrasi carbonica è solubile e viene secreta, alcuni sono legati alle membrane di specifiche cellule epiteliari.
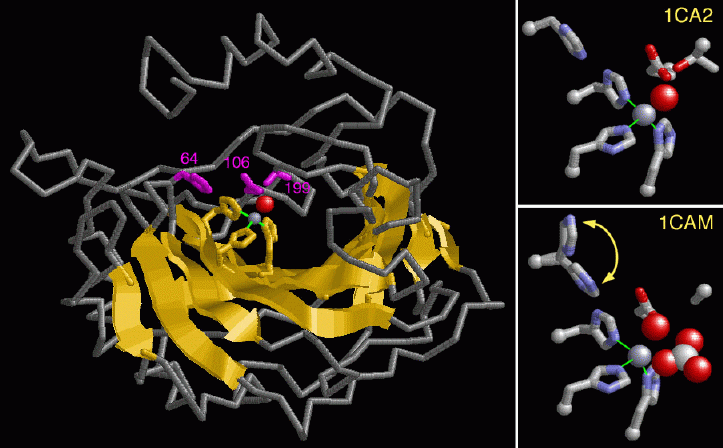
Si
noti la grande porzione con struttura beta a foglio, colorata in
giallo, nel centro della figura . Il sito attivo giace al fondo di una
fenditura profonda nell'enzima dove è legato un atomo di zinco,
rappresentato con una sfera grigia. Gli atomi di azoto di tre istidine
(numerate 94, 96 e 119 e colorate in giallo) legano direttamente lo
zinco. Questi amminoacidi sono estremamente conservati in ogni isozima.
Atomi della treonina 199 e del glutammato 106 (colorati in magenta)
interagiscono indirettamente attraverso una molecola d'acqua legata,
mostrata con una sfera rossa. Si noti che questi residui oltre
all'istidina 64 (anche questa colorata in magenta) aiutano a portare
sullo zinco un ione idrossido.
Lo zinco è la chiave di questa reazione enzimatica. L'acqua legata allo ione zinco viene scissa in un protone ed uno ione idrossido. Poichè lo zinco è uno ione positivo, stabilizza lo ione idrossido carico negativamente che così può attaccare l'anidride carbonica. Nelle due immagini sulla destra si può vedere un primo piano dello ione zinco legato alle catene laterali degli amminoacidi del sito attivo. La figura in alto, mostra lo ione idrossido rappresentato con una sfera rossa, legato allo ione zinco. Lo zinco dirige il trasferimento di questo ione idrossido all'anidride carbonica, formando uno ione bicarbonato. La figura in basso mostra una struttura intermedia dove lo ione bicarbonato, rappresentato con sfere rosse e bianche, si è appena formato ed è ancora legato all'enzima.
L'istidina 64 oscilla avvicinandosi e allontanandosi dallo ione zinco ad ogni ciclo enzimatico aiutando lo zinco a ricaricarsi con un nuovo ione idrossido. Le due posizioni di questo residuo, mostrate nella figura in basso a destra, illustrano il suo movimento durante l'azione dell'enzima. Appena lo zinco si è ricaricato con una nuova molecola di acqua e lo ione bicarbonato è stato rilasciato, l'enzima sarà pronto ad agire su un'altra molecola di anidride carbonica.
Lo zinco è la chiave di questa reazione enzimatica. L'acqua legata allo ione zinco viene scissa in un protone ed uno ione idrossido. Poichè lo zinco è uno ione positivo, stabilizza lo ione idrossido carico negativamente che così può attaccare l'anidride carbonica. Nelle due immagini sulla destra si può vedere un primo piano dello ione zinco legato alle catene laterali degli amminoacidi del sito attivo. La figura in alto, mostra lo ione idrossido rappresentato con una sfera rossa, legato allo ione zinco. Lo zinco dirige il trasferimento di questo ione idrossido all'anidride carbonica, formando uno ione bicarbonato. La figura in basso mostra una struttura intermedia dove lo ione bicarbonato, rappresentato con sfere rosse e bianche, si è appena formato ed è ancora legato all'enzima.
L'istidina 64 oscilla avvicinandosi e allontanandosi dallo ione zinco ad ogni ciclo enzimatico aiutando lo zinco a ricaricarsi con un nuovo ione idrossido. Le due posizioni di questo residuo, mostrate nella figura in basso a destra, illustrano il suo movimento durante l'azione dell'enzima. Appena lo zinco si è ricaricato con una nuova molecola di acqua e lo ione bicarbonato è stato rilasciato, l'enzima sarà pronto ad agire su un'altra molecola di anidride carbonica.