Elettrolisi dell’acqua
Tutti sanno che la formula chimica dell’acqua è H2O, il che significa che una molecola d’acqua è composta da due atomi di idrogeno ed un atomo di ossigeno. Tutti dovrebbero anche sapere che è possibile scomporre l’acqua nei suoi costituenti ricorrendo alla corrente elettrica, ed è appunto questa l’esperimento che ho provato a fare.
L'esistenza
dell'idrogeno è nota da secoli, ma la sua vera natura comincia ad emergere solo
intorno al XVI secolo quando Paracelso per primo descrisse un gas infiammabile
prodotto per reazione dell'acido solforico con il ferro. In seguito, nel 1760,
Henry Cavendish approfondì gli studi sulle proprietà e la preparazione
dell'idrogeno dall'acqua e nel 1783 Lavoisier diede a questo gas il nome di
idrogeno, che significa "generatore di acqua".
L'idrogeno è un gas industriale di primaria importanza. Fu
per lungo tempo utilizzato per il gonfiamento degli aerostati; ma a causa della
sua infiammabilità, che provocò gravissimi incidenti (Akron, Hindenburg,
ecc.), è stato sostituito dall'elio, leggermente più pesante ma non
infiammabile. L'idrogeno è usato come materia prima in un gran numero di
operazioni chimiche. La più importante è la sintesi dell'ammoniaca, ma vanno
anche ricordate l'idrogenazione degli oli di pesce e delle nafte, la
fabbricazione del metanolo e dei carburanti sintetici.
L’idrogeno è ormai considerato come il combustibile del
futuro, le sue particolari caratteristiche infatti, ne fanno una fonte d'energia
ideale.
Le principali tecnologie di produzione dell'idrogeno sono:
Elettrolisi dell’acqua.
Steam reforming del gas metano.
Ossidazione parziale non catalitica di
idrocarburi.
Gassificazione del carbone.
Gassificazione e pirolisi delle biomasse.
Altri metodi.
L'idrogeno può essere ottenuto tramite l’elettrolisi
dell'acqua. Questo processo fu applicato per la prima volta da Sir William Grove,
nell’anno 1839.
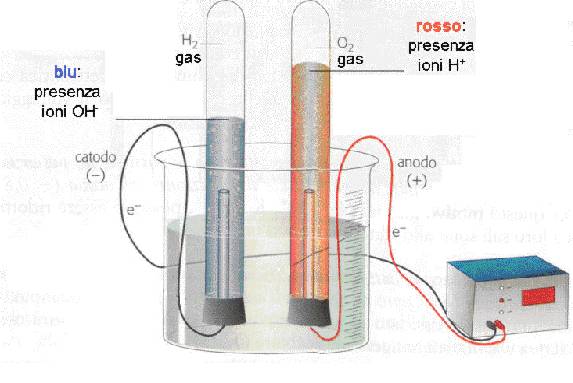
L'elettrolisi richiede il passaggio di corrente elettrica
attraverso l'acqua. La corrente entra nella cella elettrolitica tramite il
catodo, un elettrodo caricato negativamente, attraversa l'acqua e va via
attraverso l'anodo, un elettrodo caricato positivamente. L'idrogeno e l'ossigeno
così separati confluiscono rispettivamente verso il catodo e verso l'anodo.

Necessario:
1 Contenitore;
2 mine di matita;
1 pila da 4,5 volt;
un po’ di colla vinilica;
un pezzo di cavo elettrico.
Ho preso un contenitore di polistirolo e alla base ho incollato uno spessore per tenere sollevata la parte centrale. Nella parte centrale del contenitore sono state inserite le due mine sigillando con un goccio di colla vinilica la base per evitare eventuali perdite. Le mine devono sporgere nella parte inferiore del contenitore il necessario per collegarvi due fili elettrici attaccati alla pila.
Si riempie il contenitore di acqua e
successivamente si inseriscono le provette (anch’esse riempite d’acqua) a
testa in giù badando che ciascuna
provetta abbia all’interno un elettrodo.
All’interno
delle provette cominceranno a formarsi delle bollicine di gas che andranno a
raccogliersi nella parte superiore spingendo giù l’acqua. Se si aspetta un
po’ di tempo si vedrà che il volume del gas che si è formato nella provetta
collegata al polo negativo (Idrogeno) è doppio di quello formatosi
nell’altra provetta (Ossigeno).
Perché le mine e non del ferro? Poiché l’ossigeno che si libera nella reazione reagisce con quasi tutti i metalli formando ossidi l’elettrodo al polo positivo si consumerebbe rapidamente, per questo motivo negli apparecchi professionali gli elettrodi sono fatti di platino o di un metallo ricoperto da platino, una buona soluzione di ripiego è quella di usare due pezzi di mina per matita, il materiale con cui sono costruite le mine, la grafite, è un buon conduttore e non è attaccato dall’ossigeno nascente
http://digilander.libero.it/cristinomichele/TesiFely/index.htm
http://www.energoclub.it/idrogeno/produzione/elettrolisi.htm