Prof Calogero Gugliotta
Liceo Scientifico Fermi Menfi
Il
comportamento di un Gas ideale può essere descritto o da un modello
macroscopico o da un modello microscopico.
Modello macroscopico di un gas ideale
Le proprietà macroscopiche di un gas ideale sono espresse da tre leggi:
- La
legge di Boyle.
Mantenendo fissa la temperatura T e facendo variare la pressione P e il volume V comprimendo il gas del sistema termodinamico mediante il pistone, il prodotto pressione per volume rimane costante
P*V=costante (1)
- Prima
legge di Gay-Lussac
Il volume di un gas ideale a pressione costante è direttamente proporzionale alla temperatura assoluta
VµT (2)
- Seconda
legge di Gay-Lussac
La pressione di un gas ideale a volume costante è direttamente proporzionale alla temperatura assoluta
PµT (3)
Le tre leggi possono essere espresse da un’unica equazione
Equazione di stato dei gas ideali
P*V=nRT (4)
n è il numero di moli; R=8,31 J/(mol.K)
Modello microscopico di un gas ideale
(Teoria cinetica dei gas)
Vogliamo dedurre la pressione esercitata sulle pareti di un contenitore cubico da un gas ideale racchiuso in esso, riferendoci alla figura sotto.
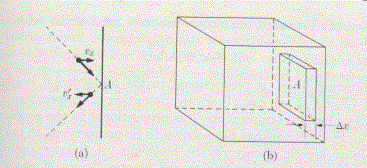
N numero di molecole in un contenitore rettangolare di volume V (area di base A e spessore Dx)
N/V numero di molecole per unità di volume
Consideriamo il volume di area A e spessore Dx a ridosso della parete.
Il numero di molecole contenuto in esso è
(N/V)V=(N/V)ADx (5)
Supponiamo che N1/V di esse abbiano una componente v1x di velocità lungo l’asse delle x. Poiché la velocità v1x è ugualmente probabile che sia positiva o negativa (metà si dirigono verso la parete e metà se ne allontanano) il numero di molecole che colpiranno in un tempo massimo Dt la parete sarà :
(N1ADx)/2V (6)
In realtà alcune di esse colpiranno la parete un po’ prima trovandosi più vicine di Dx.
Poiché l’intervallo è:
Dx=v1xDt (7)
sostituendo la (7) nella (6) si ha:
(N1Av1xDt)/2V numero di molecole che colpiscono la
parete in un tempo Dt
(N1Av1x)/2V numero di molecole che colpiscono la
parete nell’unità di tempo
Per ognuno di questi urti la quantità di moto trasferita alla parete è:
2mv1x
quantità di moto trasferita ogni urto
La forza media su A è uguale al prodotto tra la quantità di moto trasferita per urto e il numero di urti al secondo:
F1=( quantità di moto trasferita ogni urto)X(numero di molecole che colpiscono la parete nell’unità di tempo)= 2mv1x* (N1Av1x)/2V=N1mv1x2A/V
P1=F1/A=N1mv1x2/V (8)
Con analogo ragionamento si deduce:
|
P2=F2/A=N2mv2x2/V |
contributo alla pressione sulla parete da parte delle
molecole con componente v2x della velocità |
Generalizzando:
P=P1+P2+
………………Pn =m(N1v1x2 +N2v2x2+………..)/V (9)
Se definiamo la velocità quadratica media:
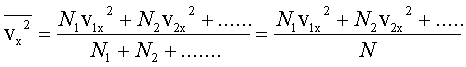
si ha:
![]()
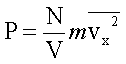 (10)
(10)
Essendo le tre componenti della velocità quadratica media ugualmente probabili, possiamo infine scrivere:
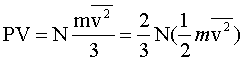 (11)
(11)
Abbiamo così a disposizione due equazioni per i gas ideali, che sono state ottenute indipendentemente l’una dall’altra, la (4) del modello macroscopico e la (11) della teoria cinetica.
Confrontando queste due equazioni otteniamo:
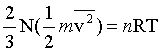 (12)
(12)
Il prodotto del numero totale N delle molecole per la massa m di ognuna di esse è la massa totale del gas, la quale può essere ottenuta come prodotto del numero n di moli del gas per la massa M di una mole del gas. Cos’ la (12) diventa:
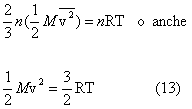
Dividendo i due membri della (13) per il numero di Avogadro NA si ha infine:
![]()
in cui k è la costante di Boltzmann k=R/NA=1,380*10-23 J/K
La (14) è un risultato notevole perché mostra che
- la
temperatura Kelvin T di un gas è direttamente proporzionale all’energia
cinetica media di traslazione delle molecole di un gas;
- tutti
i gas, indipendentemente dai volumi, dalle pressioni, dalle masse delle
singole molecole o da altre proprietà, hanno la stessa energia cinetica
media se sono alla stessa temperatura