valenza stechiometrica ed elettronica
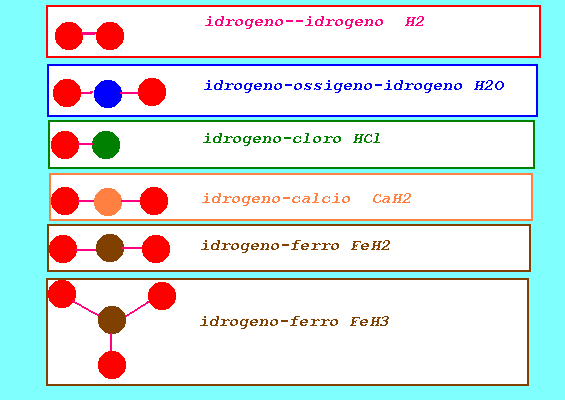
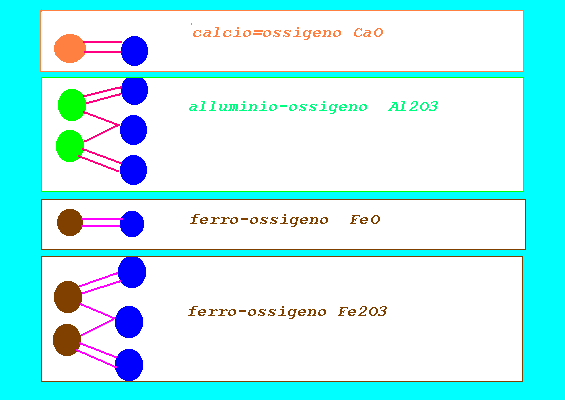
valenza stechiometrica: numero che indica la capacità di un atomo di un elemento di unirsi ad atomi di idrogeno o sostituirlo nei suoi composti (idrogeno sempre monovalente H,ossigeno sempre bivalente O) monovalente 1,bivalente 2,trivalente 3,tetravalente 4,pentavalente 5, esavalente 6,eptavalente 7 (qualche elemento può presentare sempre solo una valenza;altri possono presentare varie valenze in composti diversi con gli stessi elementi costituenti) dall'analisi dei composti con H si ricava la valenza degli elementi(H=1) HCl cloro Cl monovalente lega 1 H NaH sodio Na monovalente lega 1 H CaH2 calcio Ca bivalente lega 2 H H2O ossigeno O bivalente lega 2 H AlH3 alluminio Al trivalente lega 3 H SnH2 stagno Sn bivalente lega 2 H SnH4 stagno Sn tetravalente lega 4 H FeH2 ferro Fe bivalente lega 2 H FeH3 ferro Fe trivalente lega 3 H dall'analisi dei composti con O si ricava la valenza degli elementi(O=2) K2O potassio K monovalente FeO ferro Fe bivalente Fe2O3 ferro Fe trivalente Al2O3 alluminio Al trivalente PbO2 piombo Pb tetravalente N2O3 azoto N trivalente N2O5 azoto N pentavalente SO2 zolfo S tetravalente SO3 zolfo S esavalente Cl2O5 cloro Cl pentavalente Cl2O7 cloro Cl eptavalente conoscendo le valenze si possono scrivere le formule dei composti binari indicando i simboli degli elementi e il numero di atomi presenti nel composto (indici numerici):praticamente si scrivono come indici le valenze degli elementi scambiandole di posto(da numeri romani a numeri arabici) alluminio e ossigeno Al(III) O(II) ----> Al2O3 cloro e ossigeno Cl(V) O(II) ----> Cl2O5 sodio e ossigeno Na(I) O(II) ----> Na2OI...Na2O zolfo e ossigeno S(VI) O(II) ----> S2O6 ...SO3 (semplificando) azoto e ossigeno N(V) O(II) ----> N2O5 le formule di composti ternari vengono ottenute con altre regole(cfr.)

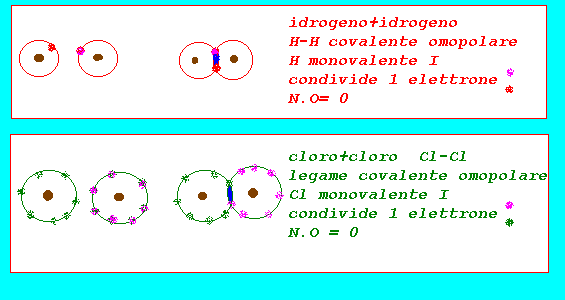
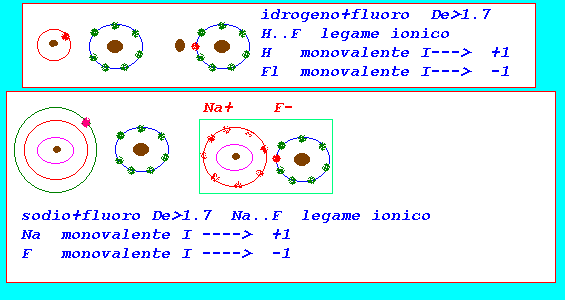
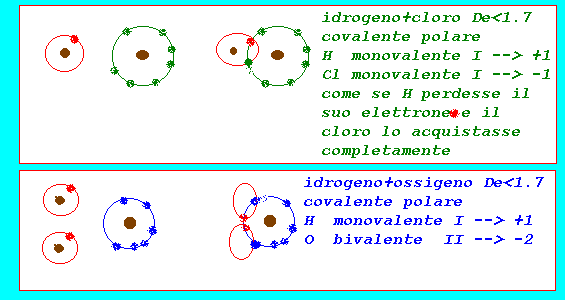
la valenza elettronica indica il numero di elettroni che un atomo cede,acquista,condivide quando si unisce ad altri atomi nella formazione delle molecole:in pratica assume gli stessi valori della valenza stechiometrica interpretandoli alla luce della formazione dei legami chimici che coinvolgono sempre gli elettroni dell'ultimo livello(elettroni di valenza) numero di ossidazione:valore numerico formale(approssimazione pratica) che indica il numero di cariche (+,-) associate ad un atomo nello stato elementare,ionico,in un composto (in pratica corrisponde alla valenza elettronica preceduta dai segni + o - per indicare se gli elettroni sono stati formalmente ceduti o acquistati:per convenzione anche nel legame covalente polare si assume che gli elettroni vengano ceduti dall'elemento meno elettronegativo e acquistati da quello più elettronegativo) regole pratiche per assegnare N.O numero o stato di ossidazione: elemento allo stato elementare H2...Cl2...O2...Na..Ca..=0 elemento in composti con legame covalente polare: fluoro F =-1 ossigeno O =-2....(-1 H2O2....+2 F2O) idrogeno H =+1....(-1 NaH....KH...AlH3..) cloro Cl =-1....(+1,+3,+5+7 con O) iodio I =-1....(+ con O) bromo Br =-1....(+ con O) metalli X =+1,+2,+3,+4 la somma algebrica degli elementi presenti in una molecola = 0 (tale regola permette di determinare N.O.di elementi presenti)
legame tipo covalente omopolare
legame tipo ionico
legame tipo covalente polare
assegnazione pratica dei numeri di ossidazione
applicando le regole indicate si può assegnare il N.O. per ogni elemento presente in una formula assegnata H2 stato elementare H = 0 Cl2 stato elementare Cl= 0 HCl H +1(1) Cl-1 (+1-1=0) H2SO3 H +1(2) O -2(3) -6+2=-4 S +4 (-6+2+4=0) H2SO4 H +1(2) O -2(4) -8+2=-6 S +6 (-8+2+6=0) NNO3 H +1(1) O -2(3) -6+1=-5 N +5 (-6+1+5=0) NaNO2 Na+1(1) O -2(2) -4+1=-3 N +3 (-4+1+3=0) Al(OH)3 H +1(3) O -2(3) -6+3=-3 Al +3 (-6+3+3=0)