spettroscopia
La luce visibile,con i suoi colori,è una forma di energia,elettromagnetica, e si presenta come un insieme di radiazioni con lunghezza d'onda e frequenza caratteristichela energia collegata ad ogni radiazione è ben determinata e dipende dalla frequenza(f) della radiazione e da una costante(h)(di Planck) E = hf . I colori ottenuti scomponendo la luce bianca con un prisma sono in ordine di frequenza crescente: rosso,arancione,giallo,verde,azzurro,indaco,violetto. La frequenza di una radiazione si può prevedere conoscendo la energia collegata f = E/h e la lunghezza d'onda L = c/f . Per spiegare l'origine delle radiazioni luminose si deve considerare la stuttura atomica a livello di distribuzione elettronica e le possibili transizioni degli elettroni mediante assorbimento o emissione di energia. Ogni elemento chimico presenta una distribuzione elettronica caratteristica: gli elettroni sono localizzati in ben definiti livelli energetici che presentano valori diversi nei diversi elementi ogni elettrone può passare da un livello più interno,meno energetico,ad un livello più esterno,più energetico,se riceve energia (mediante fotone) pari alla differenza tra energia del livello maggiore ed energia del livello inferiore DE = Em - Ei :se la sostanza vaporizzata viene investita da un flusso di fotoni di varie energie (luce bianca) potrà assorbire i fotoni di energia adeguata alle transizioni possibili per gli atomi della sostanza,mentre lascierà proseguire gli altri fotoni:la luce trasmessa,esaminata con uno spettroscopio,presenterà una gamma colorata continua(dal rosso al violetto) dovuta all'insieme dei fotoni trasmessi,e una serie di righe nere,sul fondo colorato continuo, corrispondenti alle frequenze dei fotoni assorbiti dalla sostanza:si ottiene uno spettro di assorbimento,caratteristico per ogni elemento puro. ogni elettrone può passare da un livello superiore ad un livello inferiore se emette energia pari alla differenza DE = Em - Ei :tale energia viene emesse sotto forma di radiazione con frequenza f = DE/h le radiazioni emesse in queste transizioni si possono esaminare con uno spettroscopio e si presentano come righe colorate,con specifica lunghezza d'onda,su uno sfondo nero:spettro di emissione caratteristico per ogni elemento chimico puro.
rappresentazione livelli energetici disponibili per gli elettroni in un atomo generico

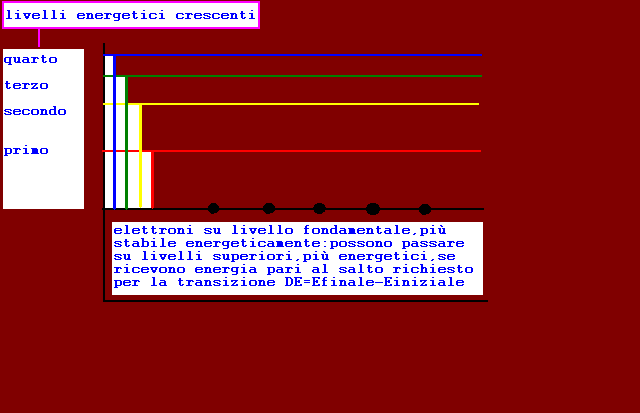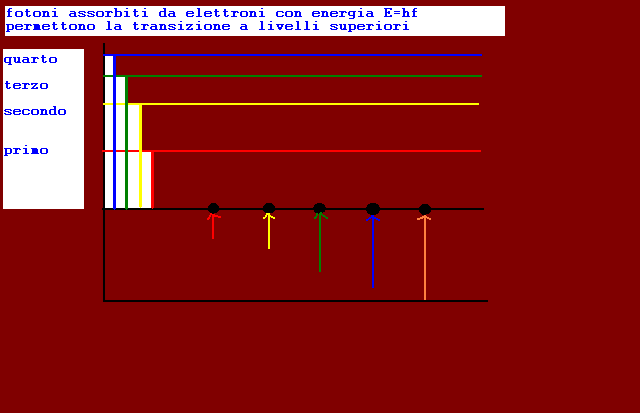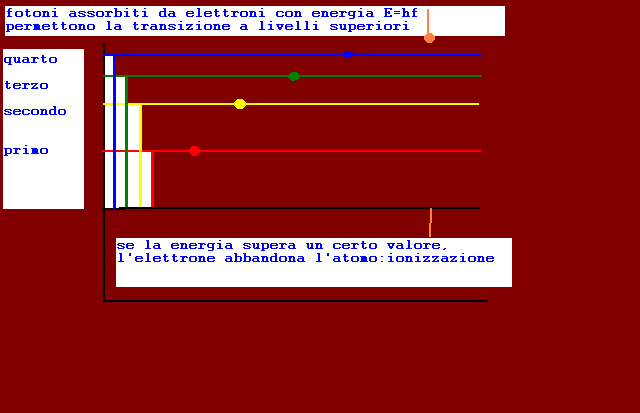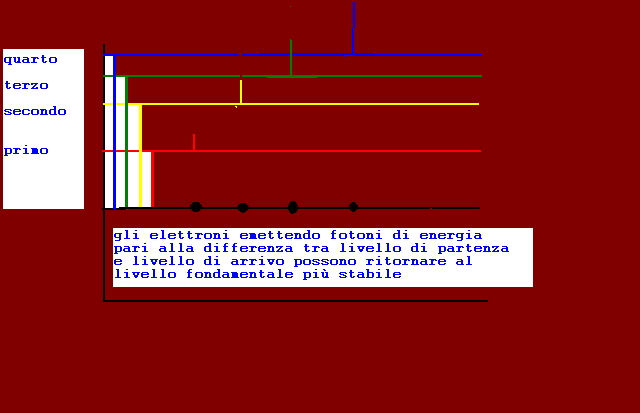
fotoni con energie proporzionali alle frequenze,se assorbiti dagli elettroni nello stato fondamentale,più stabile,meno energetico,possono spostare gli elettroni su livelli superiori,più energetici:con questo meccanismo viene prodotto lo spettro di assorbimento,righe nere su fondo colorato,caratteristico per ogni elemento chimico

transizione degli elettroni da livello fondamentale a livelli superiori

spettro di emissione:righe colorate su sfondo nero:lunghezza d'onda delle righe(posizione)caratteristica per ogni elemento chimico,prodotto dai fotoni con energia hf emesse quando gli elettroni passano da livelli più energetici(esterni) a livelli meno energetici(interni)
spettro di assorbimento:righe nere su sfondo colorato continuo:posizione delle righe nere coincidente con quelle di emissione per lo stesso elemento:sono dovute all'assorbimento di fotoni con energia hf da parte di elettroni che passano così da livelli più interni a livelli più esterni,privando di alcune frequenze lo spettro della luce continua che dalla sorgente emittente giunge allo osservatore generando lo spettro continuo con righe nere nella posizione delle frequenze assorbite
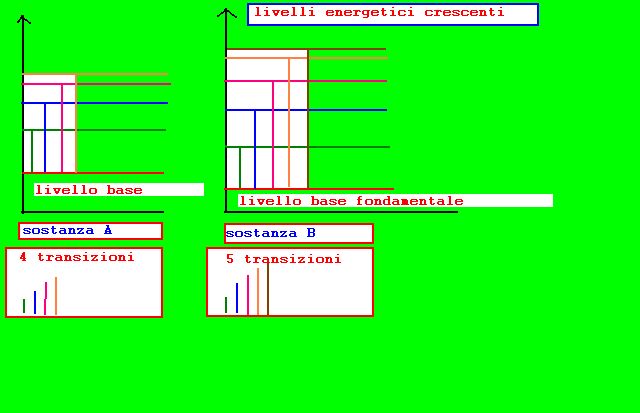
esempi di spettri di emissione e assorbimento per due sostanze diverse:A,B

rappresentazione dei livelli energetici con diverso contenuto energetico per due sostanze A,B:le possibili transizioni tra livelli hanno valori diversi nei due elementi,e quindi anche i fotoni emessi o assorbiti in tali transizioni hanno energia e quindi frequenza diversa per le due sostanze,generando spettri di emissione e di assorbimento caratteristici per ogni sostanza :a righe o a bande in funzione dello stato atomico o molecolare
ogni elettrone passa dal livello fondamentale ad un livello più energetico se assorbe un fotone con energia hf pari alla differenza tra i due livelli(di arrivo e fondamentale)
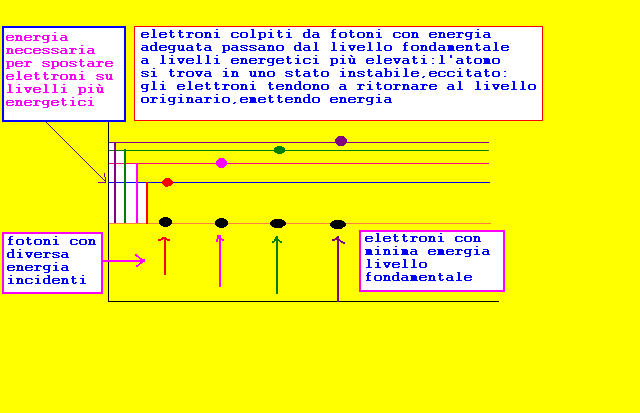
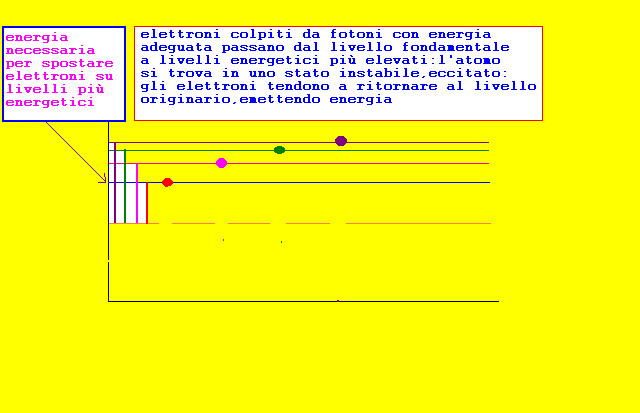
fase di assorbimento,eccitazione

fase di transizione a livelli superiori
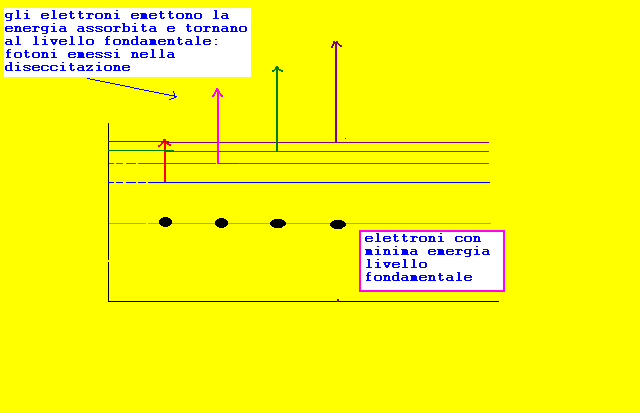
fase di diseccitazione con emissione di energia sotto forma di fotoni hf
prego attendere per animazione