
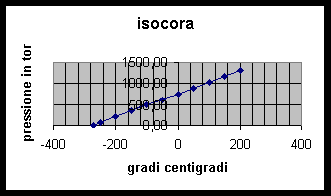
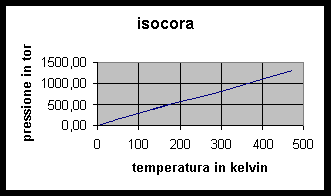
legge isocora o isovolumica
sperimentalmente si osserva che riscaldando una determinata massa di un gas qualsiasi,se si mantiene costante il suo volume,la pressione aumenta in proporzione all'aumento di temperatura,e la variazione di pressione equivalente alla variazione di un grado di temperatura risulta sempre identica (pari a una frazione delle pressione a 0°C :1/273): quindi la pressione ad una certa temperatura Pt equivale alla pressione a 0°C Po + l'aumento di pressione per grado di temperatura moltiplicato per la variazione totale di temperatura: Pt = Po + Po*Dt/273 introducendo la temperatura assoluta in gradi kelvin,con °K = 273+°C si ottiene una nuova formulazione P = Po*T/273 :la pressione del gas risulta proporzionale alla sua temperatura assoluta.

la pressione di un gas misurata a volume costante aumenta in modo proporzionale alla variazione di temperatura centigrada secondo la relazione :Pt = Po + Po*dt/273 oppure introducendo la temperatura assoluta in gradi kelvin(K = 273+°C) :P = Po*T/273 = KT
760 |
Pt=Po+Po*dt/273 | P=K*T |
costante |
|
centigradi |
pressione in tor |
kelvin |
pressione in tor |
pressione/kelvin |
-270 |
8,35 |
3 |
8,35 |
2,78 |
-250 |
64,03 |
23 |
64,03 |
2,78 |
-200 |
203,22 |
73 |
203,22 |
2,78 |
-150 |
342,42 |
123 |
342,42 |
2,78 |
-100 |
481,61 |
173 |
481,61 |
2,78 |
-150 |
342,42 |
123 |
342,42 |
2,78 |
-100 |
481,61 |
173 |
481,61 |
2,78 |
-50 |
620,81 |
223 |
620,81 |
2,78 |
0 |
760,00 |
273 |
760,00 |
2,78 |
50 |
899,19 |
323 |
899,19 |
2,78 |
100 |
1038,39 |
373 |
1038,39 |
2,78 |
150 |
1177,58 |
423 |
1177,58 |
2,78 |
200 |
1316,78 |
473 |
1316,78 |
2,78 |
attendere animazione,prego
