interazione tra forze e stato fisico della materia
punti fissi e loro interpretazione
i diversi stati fisici della materia si possono considerare
dovuti all'effetto di due forze contrastanti o in equilibrio:
1-forza di disgregazione collegata alla energia cinetica delle
particelle(atomo,molecole,ioni) variabile in funzione della
temperatura
2-forza di coesione tra le particelle dovuta alle forze
intermolecolari variabili con la natura chimica delle molecole,
con i legami chimici presenti nelle molecole
(forze elettrostatiche,forze deboli di dispersione..legami H..)
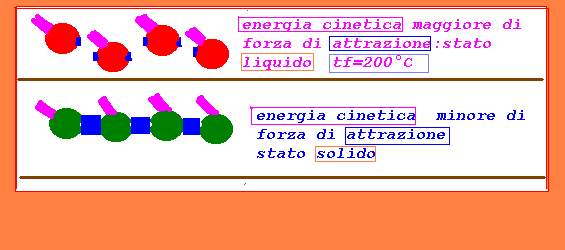
3-se prevale la forza di coesione,lo stato fisico risulta solido
se prevale la energia cinetica,lo stato risulta aeriforme
se si equivalgono energia cinetica e forza coesiva,lo stato risulta
liquido
4-a parità di energia cinetica lo stato fisico dipende dalla
diversa forza di coesione,in funzione della diversa natura
delle sostanze
5-restando costante la forza di coesione,se si aumenta la temperatura
aumenta la energia cinetica e quindi si può arrivare ad un
cambiamento di stato fisico;avviene l'inverso se si riduce la
energia cinetica abbassando la temperatura
***********************************************************************
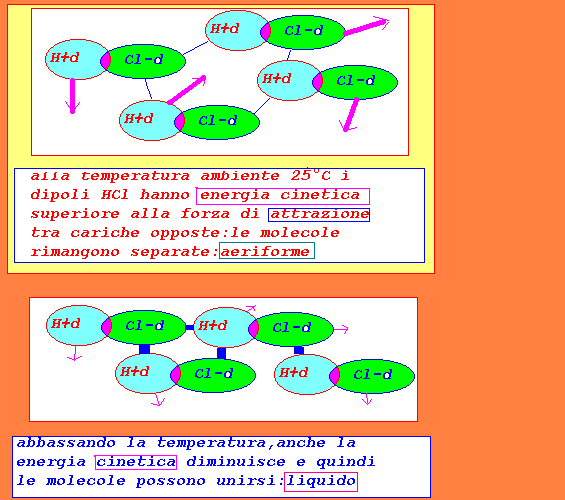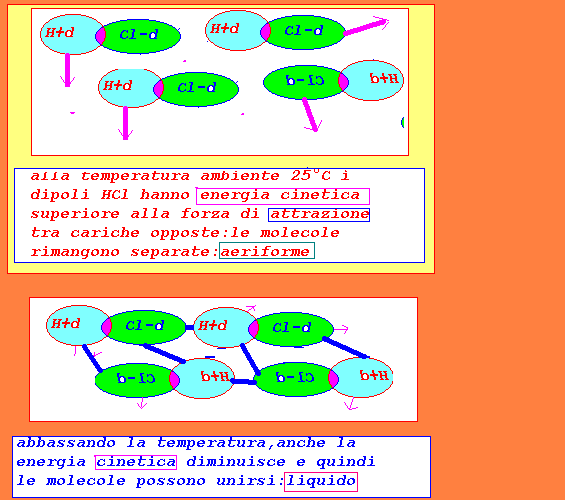
HCl...HCl molecole polari,sono dei dipoli,ma la forza di attrazione
elettrostatica risulta inferiore alla energia cinetica alla
temperatura ambiente di 25°C:di conseguenza lo stato fisico
risulta aeriforme
comprimendo il gas(obbligando le molecole a restare più
vicine(in modo da aumentare l'effetto di attrazione) e
riducendo la energia cinetica abbassando la temperatura,
si può passare allo stato fisico liquido
abbassando ulteriormente la temperatura e quindi la energia
cinetica si può passare anche allo stato fisico solido.

************************************************************************
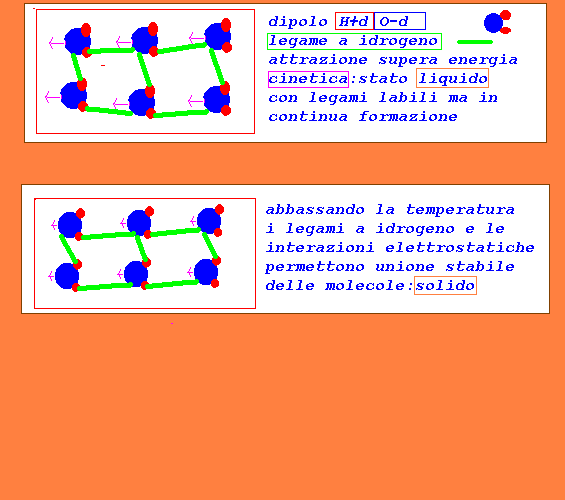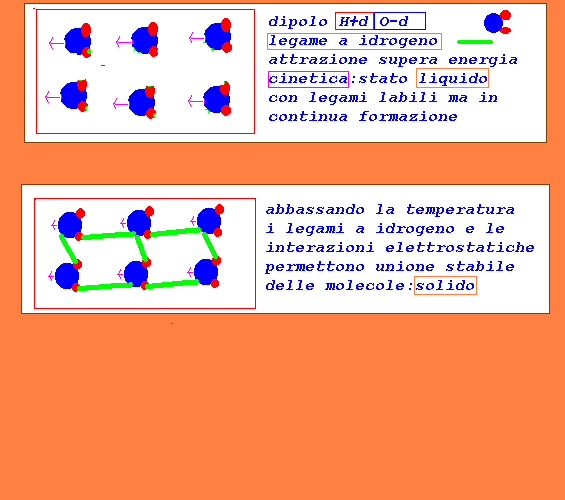
H2O...H2O molecole polari,sono dei dipoli più forti di HCl
e la forza di attrazione tra cariche opposte
risulta maggiore della energia cinetica alla
temperatura ambiente di 25°C:inoltre si possono formare
anche legami a idrogeno che favoriscono il mantenimemto
dell'unione tra le molecole:liquido (con possibilità
di spostamento delle molecole e rottura e formazione
di legami intermolecolari continua)
abbassando la temperatura si riduce ulteriormente la
energia cinetica e le molecole rimangono stabilmente
unite:solido
***********************************************************************
H2S...H2S molecole polari,sono dei dipoli più deboli di H2O
e la forza di attrazione tra cariche opposte
risulta minore della energia cinetica alla
temperatura ambiente di 25°C:inoltre non si possono formare
legami a idrogeno (essendo S poco elettronegativo):gassoso
abbassando la temperatura si riduce ulteriormente la
energia cinetica e le molecole possono unirsi im modo
labile ma continuo:liquido
si comporta come HCl perchè dipolo poco intenso ********************************************************************
Na-Cl ioni positivi Na+ e ioni negativi Cl-
alla temperatura ambiente di 25°C sono fortemente
uniti per interazione elettrostatica tra ioni opposti:
energia cinetica inferiore ad attrazione elettrostatica:
stato solido,spazialmente ordinato,cristallino
aumentando la temperatura aumenta anche la energia
cinetica vibrazionale fino a superare quella di
attrazione:passaggio allo stato liquido(fusione)
************************************************************************
azione di forze deboli(di London o di dispersione) in molecole neutre
H2...H2 molecole di idrogeno,neutre
non esiste alcuna attrazione elettrostatica
anche se le molecole si avvicinano nel loro movimento
rimangono slegate:tuttavia abbassando molto la temperatura
e quindi la energia cinetica e obbligando con la compressione
le molecole a restare fisicamente ravvicinate,il gas può
passare allo stato liquido,con necessaria comparsa di
forze intermolecolari:origine delle forze?
gli elettroni di legame sono normalmente disposti in modo
simmetrico tra i due atomi:non compare alcuna carica
elettrica sulla molecola:ma può avvenire che casualmente
e in modo labile si abbia uno spostamento temporaneo degli
elettroni di legame verso un atomo piuttosto che verso
l'altro:comparirà quindi una debole carica elettrica
negativa su una estremità della molecola e una positiva
sull'altra estremità:nasce un dipolo spontaneo(molto debole)
tale dipolo può indurre la comparsa di altri dipoli indotti
in molecole molto ravvicinate e così a catena si possono
avere molti deboli dipoli nella massa neutra originaria:
abbassando la energia cinetica e ravvicinando le molecole
trasformate in dipoli,la attrazione debole può tuttavia
produrre il suo effetto e trasformare il gas in liquido
nota:questa interpretazione spiega perchè in ambiente normale
H2..O2..N2..Cl2..CO2..H2..Rn ecc.(tutte molecole non polari)
esistono in forma gassosa:si possono tuttavia rendere liquidi
mediante opportuno raffreddamento unito a compressione

interpretazione dei diversi punti fissi per sostanze di diversa natura (temperatura di ebollizione,di fusione di sostanze pure) 1-la fusione(passaggio dallo stato solido a quello liquido mediante assorbimento di calore) avviene,per ogni sostanza pura,a una temperatura caratteristica della sostanza,e quindi corrispondente a una specifica energia cinetica (effetto disgregatore) 2-se sostanze di natura diversa presentano diverse forze di coesione sarà necessaria una equivalente energia cinetica( e quindi temperatura) per vincere le forze interparticellari di intensità variabile in funzione della diversa intensità (funzione della natura della sostanza) 3-per questo ogni sostanza pura presenta una specifica temperatura di fusione:temperatura che assicura una energia cinetica equivalente alle diverse intensità delle forze di attrazione interparticellari