struttura
atomica della materia
1-la materia si può suddividere corpi(dodati di massa e
volume)
chimicamente,in base alle loro proprietà si possono considerare:
sostanze semplici
o elementi chimici:
non suddivisibili in altre sostanze più semplici
in natura sono 92
ogni elemento ha un suo nome e simbolo
la parte più piccola dell'elemento si chiama atomo
es.H Hidrogenum....Cu cuprum o rame...Na natrium o sodio
in funzione delle loro proprietà si possono suddividere in:
metalli,non metalli,semimetalli
sostanze composte o
composti chimici
sono formati da due o più elementi chimici diversi
in natura sono infiniti
ogni composto chimico ha un suo nome e una formula
la parte più piccola del composto si chiama molecola
es.NaCl cloruro di sodio....H2O acqua
in funzione della loro natura si possono suddividere in:
composti organici o del carbonio
composti inorganici con gli altri elementi
(ossidi basici,ossidi acidi,idrossidi,idruri,acidi,sali)
2-la materia in condizioni
ambientali normali(25°C e 1 at)
si presenta in tre stati fisici diversi:
-solido.............con forma e volume proprio
-liquido............con volume proprio e forma del contenitore
-aeriforme.......con volume e forma del contenitore
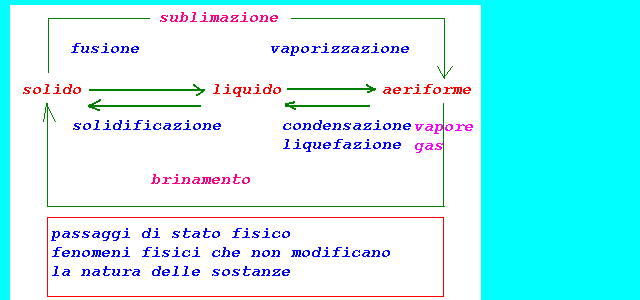
3-la materia può cambiare
di stato mediante se cambiano le
condizioni di temperatura e pressione:passaggi di stato
solido +
calore------------------(fusione)---------------------->liquido
liquido +
calore-----------------(vaporizzazione)------------>vapore
liquido -
calore------------------(solidificazione)------------->solido
vapore -
calore-----------------(condensazione)------------->liquido
gas -
calore---------------------(liquefazione)----------------->liquido
solido +
calore-----------------(sublimazione)---------------->aeriforme
aeriforme -
calore------------(brinamento)------------------->solido

ogni atomo si può considerare come un insieme formato da una parte centrale(nucleo) e una periferica(perinucleo) con forma fondamentalmente sferoidale il nucleo contiene le particelle pesanti(nucleoni) che si respingono elettrostaticamente(protoni +) e sono mantenute unite dalla forza nucleare forte mediata da gluoni protone (con carica elettrica +1 e massa unitaria 1) neutrone(con carica elettrica 0 e massa unitaria 1) il perinucleo contiene suddivisi in vari livelli energetici gli elettroni in moto attorno al nucleo e disposti secondo particolari configurazioni:sono attratti dal nucleo positivo ma rimangono in orbita attorno al nucleo per effetto del loro movimento(forza centrifuga) elettroni(con carica elettrica -1 e massa insignificante) un atomo normalmente risulta elettricamente neutro perchè le cariche positive dei protoni sono neutralizzate dalle cariche megative degli elettroni presenti in ugual numero nel perinucleo
ogni elemento chimico si diversifica dagli altri per il diverso numero di protoni presenti nel nucleo(e di elettroni presenti nel perinucleo):il numero di protoni si definisce numero atomico Z il numero di nucleoni(protoni + neutroni) presenti in un nucleo si definisce numero di massa A
ogni atomo contiene anche neutroni in numero variabile: gli atomi di uno stesso elemento,con uguale Z,che presentano diverso numero di neutroni,si definiscono isotopi dell'elemento: il numero Z rimane costante e varia solo il numero di massa A vengono indicati con simbolo(Z,A) (X,Z,A)...U(92,238) U(92,235)
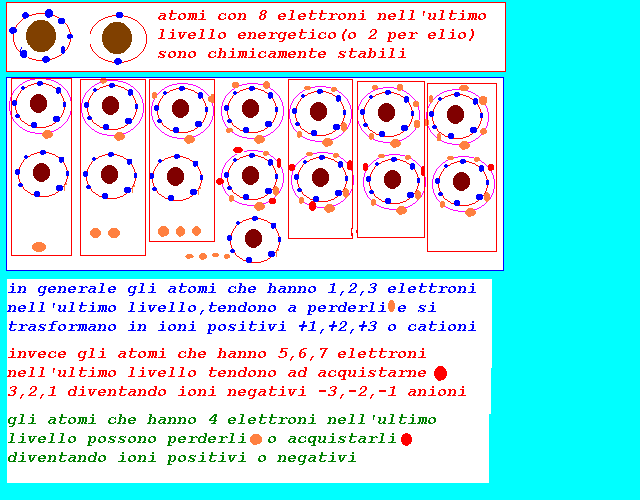
un atomo che perde elettroni diventa positivo e si definisce ione positivo o catione un atomo che acquista elettroni diventa negativo e si definisce ione negativo o anione
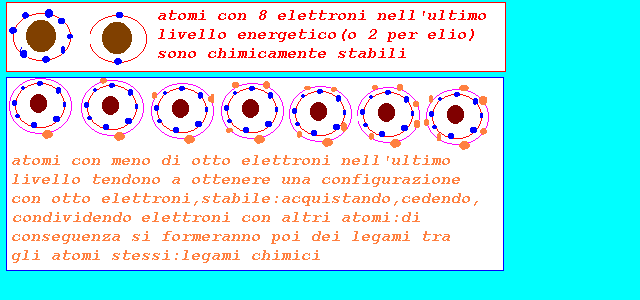
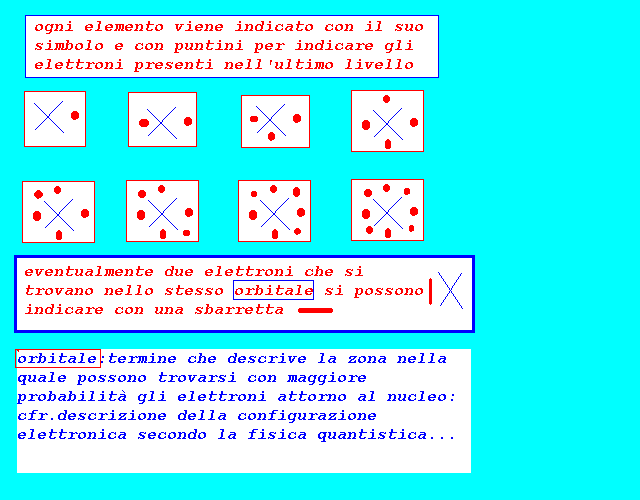
gli elettroni di dispongono attorno al nucleo seguendo leggi particolari:ogni elettrone viene individuato da 4 parametri o numeri quantici(cfr.teoria quantistica..): l'insieme degli elettroni e dei loro numeri quantici descrive la configurazione elettronica dell'atomo nella quale sono evidenziati per ogni elettrone: il livello energetico nel quale si trova il sottolivello energetico all'interno del livello energetico l'orientamento spaziale lo spin o moto di rotazione praticamente per le proprietà chimiche è sufficiente conoscere la configurazione elettronica dell'ultimo livello o livello di valenza che può contenere al massimo 8 elettroni, con la indicazione di: livello energetico N=1,2,3,4,5,6,7 sottolivello energetico(e forma dell'orbitale) s,p il numero di elettroni presenti:1,2,3,4,5,6,7,8 Ns1 1 elettrone Ns2 2 elettroni Ns2 Np1 3 elettroni Ns2 Np2 4 elettroni Ns2 Np3 5 elettroni Ns2 Np4 6 elettroni Ns2 Np5 7 elettroni Ns2 Np6 8 elettroni si osserva che elementi con 8 elettroni nell'ultimo livello Ns2 Np6 (gas nobili o gas rari) sono praticamente inerti,non reagiscono,hanno una configurazione elettronica che conferisce una particolare stabilità chimica(o 2 e nel caso dell'elio) mentre invece gli altri sono reattivi e tendono a raggiungere la configurazione elettronica stabile con 8 elettroni fondamentalmente in due maniere: 1-acquistando elettroni da inserire nell'ultimo livello se sono già presenti 5,6,7 elettroni 2-perdendo elettroni 1,2,3 se presentano nel penultimo livello una configurazione di 8 elettroni 3-acquistando o perdendo se hanno 4 elettroni nell'ultimo livello 4-condividendo il numero di elettroni appropriato con altri elementi se nessuno dei due perde o acquista del tutto gli elettroni necessari per raggiungere la stabilità in questo modo si spiegano i legami chimici tra elementi per formare gli aggregati di atomi detti molecole:cfr.legami alla fine della pagina
per vedere legami chimici avanti