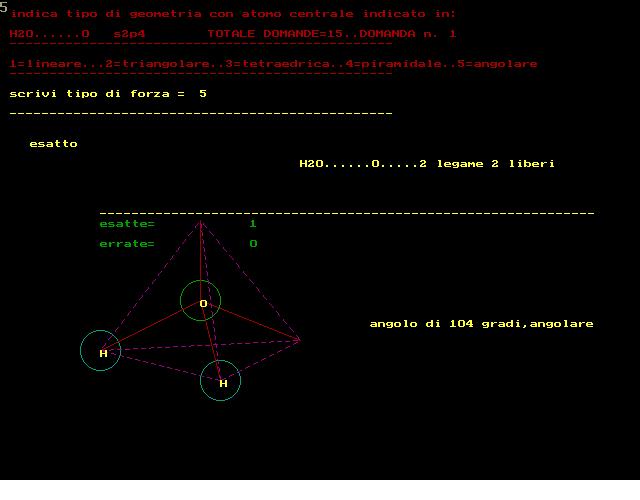
esempi di geometria molecolare
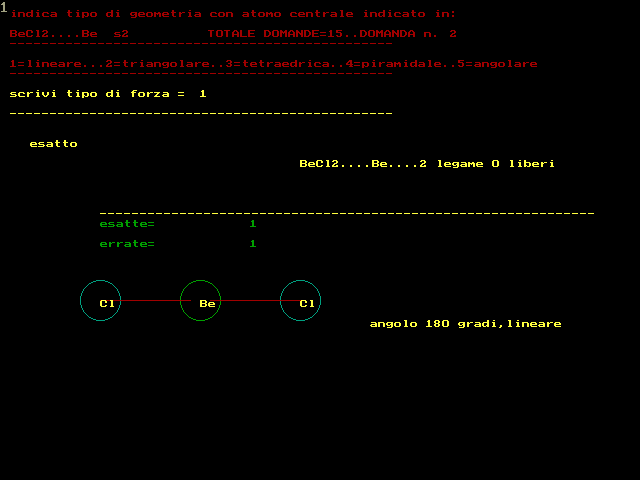
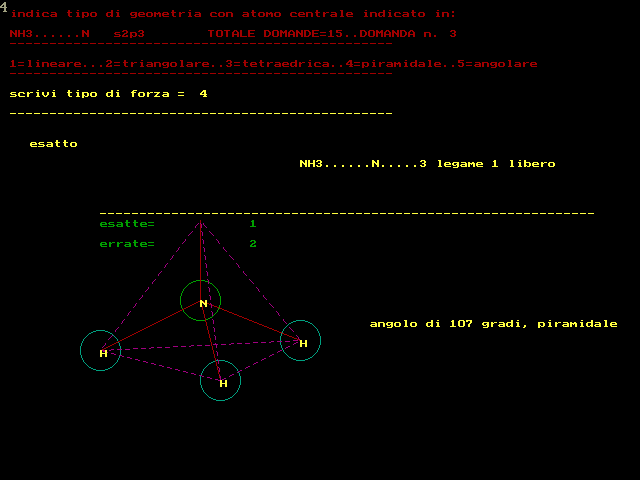
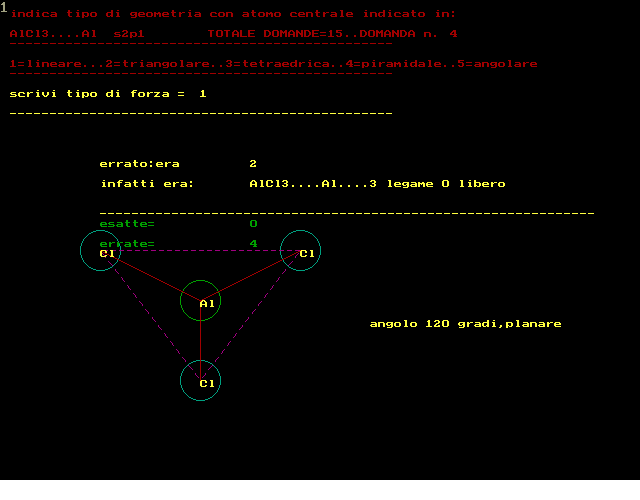
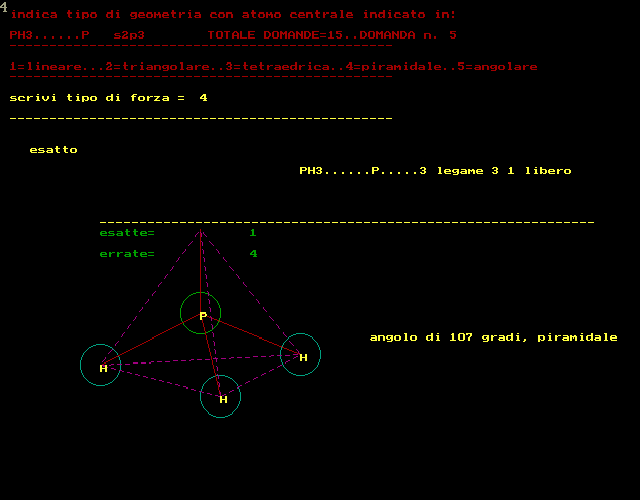
secondo la teoria VSEPR :repulsione coppie elettroni di valenza si devono rappresentare le strutture secondo Lewis si devono contare i doppietti elettronici attorno atomo CENTRALE si devono contare i doppietti di legame e quelli ancora liberi NOTA:un doppio legame equivale a 1 solo doppietto di legame e quindi prevedere tipo geometria molecolare ------------------------------------------------------- si deve rispondere scrivendo dei NUMERI al posto della forza 1 per tipo LINEARE 2 per tipo TRIANGOLARE 3 per tipo TETRAEDRICO 4 per tipo PIRAMIDALE 5 per tipo ANGOLARE --------------------------------------------------- RICORDARE che in generale la forma risulta: 1..LINEARE........con 2 doppietti di legame,0 liberi 2..TRIANGOLARE....con 3 doppietti di legame,0 liberi 2..TRIANGOLARE....con 2 doppietti di legame,1 libero 3..TETRAEDRICA....con 4 doppietti di legame,0 liberi 4..PIRAMIDALE.....con 3 doppietti di legame,1 libero 5..ANGOLARE.......con 2 doppietti di legame,2 liberi