configurazione elettronica degli atomi
configurazione elettronica:distribuzione degli elettroni di un atomo attorno al nucleo in livelli energetici,sottolivelli energetici, orbitali,con spin destrosrso o sinistrorso:i parametri assegnati ad ogni elettrone per individuarlo rispetto agli altri elettroni presenti nel perinucleo sono rappresentati da quattro valori indicati da quattro numeri(o lettere) quantici(cfr.teoria quantistica): numero quantico principale:n (1,2,3,4,5,6,7..K,L,M,N,O,P,Q) numero quantico secondario:l (0..n-1.....0,1,2,3,4,5,6...s,p,d,f,g..) numero quantico magnetico :m (-l,0,+l) numero quantico di spin :s (-1/2...+1/2)
1-ogni atomo neutro può presentare nel suo perinucleo un numero di elettroni pari al numero di protoni nucleari:numero atomico o Z 2-gli elettroni possono disporsi attorno al nucleo a distanze variabili, in funzione della loro energia,occupando specifici livelli energetici: i livelli sono indicati da numeri 1,2,3,4,5,6,7..o lettere K,L,M,N,O,P,Q.. con energia crescente da 1 a 7:il numero quantico principale indica il livello energetico n=1,2,3,4,5,6,7..,la dimensione degli orbitali 3-ogni livello energetico presenta al suo interno dei sottolivelli energetici,indicati dal numero quantico secondario l,che assume i valori in funzione del livello in cui si trova secondo la formula l=da 0 a n-1 n = 1 1 s l=0 forma sferica degli orbitali presenti 1 n = 2 2 sp l=1 forma bilobata degli orbitali presenti 4 n = 3 3 spd l=2 forma complessa degli orbitali presenti 9 n = 4 4 spdf l=3 forma complessa degli orbitali presenti 16 n = 5 5 spdfgl=4 forma complessa degli orbitali presenti 25 n = 6 6 spdf l=5 forma complessa degli orbitali presenti 36 n = 7 7 spdf l=6 forma complessa degli orbitali presenti 49 4-ogni sottolivello energetico presenta uno specifico numero di orientamenti spaziali per effetto magnetico:numero quantico magnetico=m in funzione del numero quantico secondario l,secondo la formula m = -l,0,+l l = 0 s m=0 (s) orbitali 1 s l = 1 p m= -1,0,+1 (px,py,pz) orbitali 3 px,py,pz l = 2 d m= -2,+1,0,+1,+2 orbitali 5 l = 3 f m= -3,-2,-1,0,+1,+2,+3 orbitali 7 l = 4 g m= -4,-3,-2--1,0,+1,+2,+3,+4 orbitali 9 5-ogni livello energetico possiede n^2 orbitali e 2*n^2 elettroni (ogni orbitale contiene al massimo 2 elettroni) n = 1 orbitali = 1 elettroni = 2 n = 2 orbitali = 4 elettroni = 8 n = 3 orbitali = 9 elettroni = 18 n = 4 orbitali = 16 elettroni = 32 n = 5 orbitali = 25 elettroni = 50 6-nessun elettrone può avere i quattro numeri quantici uguali a quelli di un altro elettrone presente nel perinucleo(principio di Pauli) 7-ogni elettrone tende a occupare prima i livelli e sottolivelli meno energetici(K,L,M,N,O,P,Q) e nei livelli i sottolivelli meno energetici(s,p,d,f) 8-a parità di sottolivello vengono occupati prima gli orbitali vacanti rispetto a quelli semivacanti(principio di Hund)
schematicamente
1 livello con 1 sottolivello tipo s con 1 orbitale s
2 livello con 1 sottolivello tipo s con 1 orbitale s
con 1 sottolivello tipo p con 3 orbitali px py pz a 90°
3 livello con 1 sottolivello tipo s con 1 orbitale s
con 1 sottolivello tipo p con 3 orbitali px py pz a 90°
con 1 sottolivello tipo d con 5 orbitali
4 livello con 1 sottolivello tipo s con 1 orbitale s
con 1 sottolivello tipo p con 3 orbitali px py pz a 90°
con 1 sottolivello tipo d con 5 orbitali
con 1 sottolivello tipo f con 7 orbitali
5 livello con 1 sottolivello tipo s con 1 orbitale s
con 1 sottolivello tipo p con 3 orbitali px py pz a 90°
con 1 sottolivello tipo d con 5 orbitali
con 1 sottolivello tipo f con 7 orbitali
numero di livelli energetici = 1,2,3,4,5,6,7
numero di sottolivelli per ogni livello = 1,2,3,4,5,6,7
numero di orbitali per ogni sottolivello = s=1..p=3..d=5...f=7
numero di elettroni per ogni orbitale = 2
numero di elettroni per ogni sottolivello = s=2..p=6..d=10..f=14
numero di elettroni per ogni livello = 2..8..18..32..50

in pratica solo i livelli 1,2,3,4 hanno i sottolivelli occupati secondo la regola indicata:per i livelli 5,6,7 si indicano solo alcuni orbitali che possono essere occupati:per le applicazioni pratiche a livello didattico sono sufficienti le configurazioni sotto indicate
sottolivelli orbitali elettroni 1s2 1 s 1 1s 2 2s2 2p6 2 sp 4 1s 3p 8 3s2 3p6 3d10 3 spd 9 1s 3p 5d 18 4s2 4p6 4d10 4f14 4 spdf 16 1s 3p 5d 7f 32 5s2 5p6 5d10 5f14 4 spdf 16 1s 3p 5d 7f 32 6s2 6p6 6d10 6f14 4 spdf 16 1s 3p 5d 7f 32 7s2 7p6 7d10 7f14 4 spdf 16 1s 3p 5d 7f 32
per rappresentare la distribuzione degli elettroni nel perinucleo,
configurazione elettronica,si possono usare diverse modalità:
configurazione analitica e completa:ogni elettrone viene indicato
dai suoi 4 numeri quantici:
Z=6 1,0,0,+1...1,0,0,-1...2,0,0,+1...2,0,0,-1..2,1,-1,+1..2,1,0,-1
1s+ 1s- 2s+ 2s- 2px+ 2py+
configurazione sintetica completa:si indicano solo livelli e sottolivelli
Z=6 1s2....2s2 2p2
configurazione sintetica ultimo livello o di valenza
Z=6 2s2 2p2
configurazione simbolica per ultimo livello
Z=6 :X:

in pratica è importante la configurazione dell'ultimo livello che risulta del tipo:
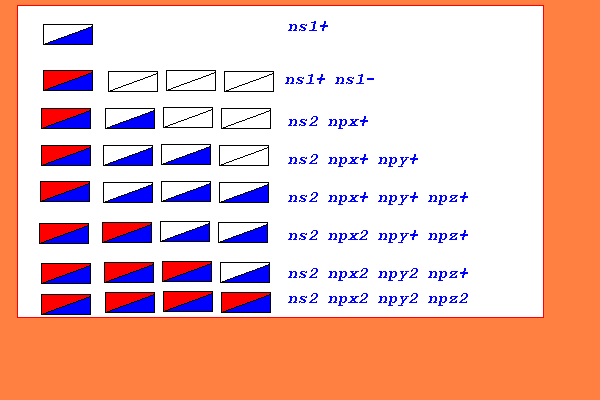
ogni atomo,nell'ultimo livello,presenta sempre una configurazione con un numero di elettroni variabile da 1 a 8,appartenenti sempre ai sottolivelli sp,con configurazioni indicate sotto(non si indica il livello energetico n per schematizzazione) 1 ns1.........ns1+ X. 2 ns2.........ns1+ ns1- X: 3 ns2p1.......ns1+ ns1- npx+ :X. 4 ns2p2.......ns1+ ns1- npx+ npy+ :X: 5 ns2p3.......ns1+ ns1- npx+ npy+ npz+ :X:. 6 ns2p4.......ns1+ ns1- npx+ npy+ npz+ npx- :X:: 7 ns2p5.......ns1+ ns1- npx+ npy+ npz+ npx- npy- :X::. 8 ns2p6.......ns1+ ns1- npx+ npy+ npz+ npx- npy- npz- ::X::