
3. Fisiologia della stimolazione elettrica del cuore
Indice
1. Biofisica della membrana cellulare
2. La membrana cellulare quale condensatore
3. Fenomeni elettrici negli stati di riposo e di attività
4. Potenziale stabile di riposo
6. Eccitazione di una fibra miocardica
7. Effetto di un flusso di corrente subliminale sull'eccitabilità
8. Variazione della permeabilità ionica in rapporto con il potenziale di azione
10. Attivazione cardiaca normale
1. Biofisica della membrana cellulare
Ogni organo è formato da un certo numero di cellule e dalla soluzione che le bagna, detta liquido interstiziale.
Il plasma cellulare, liquido intracellulare, ed il liquido interstiziale hanno struttura simile; essi sono in linea di massima costituiti da acqua ed entrambi i liquidi contengono all'incirca un uguale numero di particelle disciolte per unità di volume.
Il confine tra il liquido intracellulare ed il liquido interstiziale è rappresentato da un sottile strato non acquoso (100 Ångstrom), chiamata membrana cellulare di particolari caratteristiche elettrofisiologiche, anatomiche e biochimiche.55 (Si rammenta che: 1 Å = 10-7 mm).
Le differenze fra liquido intracellulare e liquido interstiziale sono molto più importanti di quanto non siano le loro analogie.
Le concentrazioni del Na+ e del Cl- sono assai più elevate nel liquido interstiziale di quanto non siano nel liquido intracellulare.
Una situazione opposta si rileva per il K+ la cui concentrazione è molto più elevata nel liquido intracellulare che in quello interstiziale.
Esiste una differenza di potenziale elettrico tra liquido intracellulare e liquido interstiziale.
Fra le cellule del muscolo scheletrico il liquido intracellulare ha un potenziale negativo, pari a -90 mV, rispetto al liquido interstiziale.
Poiché queste marcate differenze di concentrazione e di potenziale si verificano ai lati della sottile membrana cellulare, appare logico supporre che detta membrana abbia una notevole importanza nel mantenimento di tale diversità. Il divario di concentrazione e di potenziale dipende principalmente dalle proprietà di tale membrana cellulare, come segue:
1. gli ioni si diffondono attraverso la membrana ad una velocità che rappresenta una piccola frazione di quella con cui essi si diffondono nell’acqua;
2. l’ostacolo alla diffusione è probabilmente conseguenza della struttura stessa della membrana, che è costituita da sottili strati alternati di lipidi e di protidi. Nella maggiore parte delle membrane cellulari, la velocità di diffusione del Na+ è molto minore di quella del K+ e del Cl-;
3. l'energia derivata dal metabolismo viene adoperata dalle cellule per trasportare Na+ all'esterno della cellula e K+ all'interno.
Questi movimenti ionici si controbilanciano esattamente e mantengono all'interno delle cellule, la concentrazione del Na+ bassa e quella del K+ alta.
Pertanto, l'importanza della membrana cellulare per la funzione della cellula, è quella di regolare l'interscambio tra una cellula ed il liquido che la circonda.
I fattori che influenzano la diffusione ionica attraverso la membrana sono considerati passivi e attivi.
Le forze passive sono rappresentate:
1. dalle differenze di concentrazione elettrolitica trans-membrana che, agendo nella direzione del gradiente osmotico, tende a far uscire il K dalla cellula e a farvi entrare il Na;
2. dalla struttura della membrana cellulare e dalle sue caratteristiche descritte nel paragrafo seguente;
3. dalle differenze di potenziale transmembrana, che agisce in senso opposto alla prima.
Il trasporto attivo rappresenta il risultato dell'attività della cellula che usa la propria energia metabolica per far uscire il sodio e mantenere una elevata concentrazione di potassio.
La relazione esistente fra assunzione di potassio ed espulsione di sodio spiega il leggero squilibrio nella distribuzione del potassio; la netta diffusione di K+ all'esterno è equilibrata dal pompaggio dello ione verso l'interno.
Il potenziale transmembrana aumenta perché la membrana è molto più permeabile al potassio che al sodio, e perché la pompa del sodio mantiene la concentrazione interna del sodio a valori più bassi.
Gli ioni K+ si diffonderebbero all'esterno della cellula più rapidamente di quanto gli ioni Na+ si diffonderebbero all'interno, se non esistesse un potenziale di membrana.
Gli ioni K+, che si diffondono al di fuori, lasciano dietro di loro gli anioni ed in tal modo caricano la membrana cellulare.55
2. La membrana cellulare quale condensatore
Un conduttore è una sostanza in cui le cariche sono libere di muoversi.
I metalli e le soluzioni saline sono buoni conduttori: i primi perché gli elettroni dello strato esterno non sono legati stabilmente ai nuclei, le seconde perché le particelle del soluto sono cariche (ionizzate) e si possono muovere liberamente nel solvente.
Poiché le cariche hanno la possibilità di spostarsi liberamente in un conduttore, se ciò non avviene significa che all'interno di esso non esiste alcun campo elettrico.55
Ogni regione in cui vi siano cariche fisse come il vuoto, è detta isolatore.
In un materiale isolante (che viene chiamato dielettrico) tutte le cariche sono strettamente legate e non possono migrare sotto l'influenza di un campo elettrico esterno.
Le cariche in un dielettrico non sono fisse in modo rigido, e, per conseguenza, si possono leggermente separare in un campo esterno.55
Qualsiasi sistema costituito da due conduttori, separati da un isolatore, viene detto condensatore.
La costante di proporzionalità che mette in relazione la carica con il voltaggio si chiama capacità C di un condensatore. Essa dipende dalla disposizione geometrica dei conduttori, e cioè dalla loro estensione e separazione nello spazio, e dalla costante dielettrica della sostanza isolante.
Queste due dipendenze si verificano perché la forza tra i conduttori è determinata dalla distanza che li separa, e perché la distribuzione relativa delle cariche sulla superficie di un conduttore isolato è la stessa qualunque sia la quantità di cariche del suo conduttore.
Quanto minore è il lavoro, per un’unità di carica, necessario per caricare un condensatore, tanto maggiore è la capacità del condensatore.
Una cellula animale ed il liquido che la circonda formano un condensatore: i due conduttori sono il liquido interstiziale ed il liquido intracellulare, e l'isolatore che li separa è la membrana cellulare.
Dato che gli ioni, entro certi limiti possono penetrare attraverso la membrana, la cellula non è un condensatore perfetto.
Cariche separate attraverso la membrana potrebbero sfuggire, se non vi fossero dei mezzi per ricostruire la carica non appena sfugge.
Poiché la membrana è estremamente sottile (100 Å), la sua capacità è relativamente elevata.
La cellula può essere considerata come un condensatore a placche parallele, perché la distanza tra i due conduttori è breve rispetto al diametro della cellula.
La carica della membrana si esprime in termini di capacità per unità di superfici, perché la capacità di un condensatore a placche parallele è proporzionale alla sua superficie.
L'unità di capacità è il Farad. Un condensatore ha la capacità di 1 Farad e produce la differenza di potenziale di 1 Volt fra le placche se la carica è di 1 Coulomb.
In termini di grandezza fisica, un condensatore di 1 Farad è molto grande, ed i condensatori che si usano normalmente hanno capacità dell'ordine di 1 mFarad (Farad x 10-6).
Le capacità delle fibre dei muscoli scheletrici della rana sono di circa 10 microfarad per cm2; poiché le cariche separate dalla membrana sono ioni, la quantità di carica può essere resa più significativa se la si esprime in Moli (M) per cm2 piuttosto che per Coulomb per cm2.
In 1 M di qualsiasi sostanza, vi sono 6,023 x 1023 molecole, ed uno ione monovalente ha la carica di ± 1 elettrone. Poiché un elettrone ha la carica di 1 M di ioni monovalenti, essa è pari a 96.500 Coulomb per ogni M di ioni monovalenti. Ne consegue, ad esempio, che una carica di 9 x 10-7 Coulomb per cm2 sulla membrana di una fibra muscolare sta a significare che ci sono solo 9,5 x 10-12 M di ioni separati da 1 cm2 di membrana cellulare.
Per confronto, 1 cm3 di liquido interstiziale o intracellulare contiene 1,5 x 10-6 M di cationi o anioni. Quindi uno strato di liquido interstiziale dello spessore di 6 Å è sufficiente a fornire gli ioni necessari per caricare la capacità della membrana cellulare fino a 90 millivolt.55
3. Fenomeni elettrici negli stati di riposo e di attività
Una conoscenza più profonda dei fenomeni elettrici che si verificano a carico delle cellule muscolari e nervose è stata resa possibile solo dopo che nel 1939 e 1940 Coole e Curtis negli Stati Uniti, e Hodgkin e Huxley in Inghilterra usarono microelettrodi che potevano essere introdotti attraverso la membrana cellulare senza ledere la cellula.
4. Potenziale stabile di riposo
Le fibre nervose e muscolari mantengono un potenziale stabile, essendo l'interno elettronegativo, tra un lato e l'altro della loro membrana. Di solito questo potenziale viene detto potenziale di riposo, per distinguerlo dal potenziale di azione. L'ampiezza del potenziale di riposo è determinata dal trasporto sodio-potassio e dipende in gran parte dalla permeabilità relativa della membrana a questi ioni.
Quanto maggiore è il rapporto tra la permeabilità al sodio e la permeabilità al potassio, tanto maggiore è il potenziale. Nelle fibre muscolari questo rapporto è molto elevato, circa 50 a 1, ed il potenziale di riposo varia da -70 a -90 millivolt. Nello stato stabile, gli anioni cloro sono distribuiti in equilibrio con il potenziale di riposo, mentre la concentrazione interna del sodio è assai più bassa e la concentrazione del potassio più elevata di quanto sarebbe prevedibile in base al potenziale di membrana.55
Nel 1902 Bernstein propose la teoria secondo cui il potenziale di riposo è determinato dal gradiente di concentrazione del potassio; egli fondò la sua ipotesi sul fatto che il potenziale di azione, proporzionale al potenziale di riposo, è direttamente proporzionale alla temperatura assoluta. La prova migliore in favore della teoria di Bernstein è costituita dal fatto che il potenziale di membrana varia direttamente con il variare della concentrazione esterna del potassio.
5. Potenziale di azione
Quando si fa passare una corrente elettrica dall’esterno, attraverso la membrana di un assone o di una cellula muscolare, il potenziale di membrana subisce una serie di variazioni tipiche e ciò costituisce il potenziale di azione.
Quando un microelettrodo penetra nell’interno della cellula, si registra il potenziale di riposo negativo, cioè pari a -90 mV. Allorchè, attraverso un elettrodo stimolante, si applica alla cellula un breve shock elettrico, il potenziale di membrana diminuisce rapidamente verso lo zero e lo sorpassa (overshoot) sicché per un breve periodo il potenziale di membrana è invertito, cioè l’interno della cellula diventa positivo rispetto all’esterno; dopo di che il potenziale ritorna, alquanto lentamente, a quello di riposo.
Quando lo shock viene applicato attraverso un elettrodo più lontano, la sequenza degli eventi è identica ma vi è una latenza più prolungata; per latenza si intende l’intervallo di tempo tra artefatto dello shock e inizio del potenziale di azione. Tale latenza è in rapporto diretto alla distanza fra elettrodi di stimolazione ed elettrodi di registrazione.
Quindi il potenziale di azione risulta costituito da una breve inversione del potenziale di membrana, che inizia in corrispondenza degli elettrodi stimolanti e si sposta, a velocità costante, come un’onda lungo l’asse della cellula.
Per generare un potenziale di azione con qualsiasi mezzo, è indispensabile che il potenziale di membrana diminuisca fino ad un valore critico chiamato soglia.37,39
Il potenziale di azione così ottenuto si sviluppa in modo esclusivo ed una volta instaurato è del tutto indipendente dallo stimolo che lo genera. L’energia necessaria per lo sviluppo del potenziale di azione è prodotta nella cellula stessa; lo stimolo, abbassando il potenziale di membrana, serve soltanto a mettere la cellula in attività (fig. 1).

fig. 1 - Potenziale d’azione monofasico di una fibra rapida
Una volta che lo stimolo abbia raggiunto l’intensità sufficiente per abbassare il potenziale di membrana al valore critico di soglia, ogni ulteriore aumento dell’intensità dello stimolo non esercita, quindi, alcun effetto sull’ampiezza del potenziale di azione. La cellula risponde allo stimolo con un potenziale di azione di ampiezza completa oppure non risponde affatto (legge del tutto o nulla - Bowditch 1871).
L’attivazione della cellula coincide con la fase 0, durante la quale il potenziale intracellulare riduce rapidamente la propria negatività fino ad assumere valori positivi rispetto all’esterno. Durante le fasi 1, 2 e 3 avviene la ripolarizza-zione cellulare che riporta la situazione alle condizioni di partenza, fase 4. Durante le varie fasi si verificano importanti flussi transmembrana degli ioni Na+, Ca++, K+, ecc. Tali migrazioni sono legate all’improvviso incremento della conduttanza dei rispettivi canali della membrana cellulare e dal gradiente elettrochimico esistenti tra i comparti intra ed extracellulari.
6. Eccitazione di una fibra miocardica
Il passaggio di una corrente elettrica attraverso due microelettrodi, posti uno all’interno e l’altro all’esterno della membrana cellulare, fa diminuire il potenziale di membrana fino al valore soglia.
Gran parte di tale corrente scorre dall'anodo al catodo nel liquido esterno a bassa resistenza, che circonda la fibra, e modifica solo indirettamente il potenziale di membrana.
Parte della corrente passa, invece, nell'interno attraverso la membrana, al di sotto e nelle adiacenze dell'anodo, scorre nel citoplasma, ed infine fluisce all'esterno attraverso la membrana, al livello ed in prossimità del catodo.
La densità del flusso di corrente, interna ed esterna, è massima rispettivamente nei punti che sono immediatamente sottostanti all'anodo ed al catodo. Il flusso di corrente attraverso la membrana esercita un effetto pronunciato sul potenziale di membrana, perché la membrana è dotata di una resistenza. Il passaggio di corrente attraverso una resistenza determina una caduta di potenziale tra un lato e l'altro della resistenza stessa.
Al catodo dove la corrente fluisce all'esterno attraverso la membrana, la caduta di potenziale (interno positivo, esterno negativo) è di segno opposto al potenziale di membrana di riposo (interno negativo, esterno positivo); di conseguenza il potenziale di membrana diminuisce e si dice che la membrana è ipopolarizzata o depolarizzata. All'anodo la corrente passa nell'interno attraverso la membrana; il potenziale di membrana aumenta e si dice che la membrana è iperpolarizzata.55 Il potenziale di azione inizia al catodo, se il flusso di corrente attraverso la membrana è sufficiente per ridurre il potenziale di membrana al valore di soglia, all'anodo se l'eccitabilità è diminuita.
Benché considerare la membrana come un semplice circuito di resistenza sia un utile espediente per rendere più comprensibili le variazioni del potenziale in rapporto al passaggio di corrente attraverso la membrana stessa, per avere un quadro esatto degli effetti di tale flusso di corrente è necessario tenere conto del fatto che la membrana è dotata di una resistenza elevata in quanto separa il liquido esterno ed interno che sono altamente conduttori; nel suo complesso costituisce pertanto un condensatore.
Tali proprietà capacitive della membrana, non modificano la direzione di una variazione di voltaggio provocata da un flusso di corrente attraverso la membrana stessa, mentre invece modificano notevolmente l'evoluzione temporale e la distribuzione spaziale delle variazioni di voltaggio.
Dato che in un condensatore il voltaggio è proporzionale alla carica, una corrente che passa all'esterno, attraverso la membrana in corrispondenza del catodo, per ridurre il voltaggio deve necessariamente neutralizzare parte delle cariche della membrana.
La corrente è costituita dal flusso di cariche elettriche e la modificazione della carica della membrana richiede tempo; di conseguenza il compito del condensatore è di rallentare le variazioni di voltaggio prodotte dal flusso di corrente attraverso la membrana stessa, in un qualsiasi punto della fibra. Poiché nelle fibre muscolari (come in quelle nervose) la lunghezza è molte migliaia di volte superiore al diametro, la resistenza del citoplasma al flusso di corrente è assai elevata, così che possono sussistere differenze di voltaggio tra punti diversi, lungo la cellula. Non appena il voltaggio di membrana viene modificato in una determinata regione, dalle regioni adiacenti della membrana inizia un passaggio di corrente verso di esso. Le cariche presenti nelle zone adiacenti alla membrana normalmente polarizzate, fluiscono nel liquido interstiziale verso la regione depolarizzata attraverso la membrana e ritornano, attraverso il citoplasma, ad un punto esattamente opposto al loro punto di partenza, riducendo in tal modo la carica ed il voltaggio di questa sede. Il flusso di queste cariche attraverso il citoplasma incontra una resistenza; in conseguenza di ciò, la variazione di potenziale che si verifica nelle regioni adiacenti è meno elevata e più lenta di quella che si verifica a livello del catodo.
Tale comportamento può riassumersi nei seguenti termini:
- le variazioni del potenziale di membrana, prodotte da una
corrente applicata in un punto, sono massime a livello dell'elettrodo e diminuiscono progressivamente per l'aumento della distanza dall'elettrodo;
- le variazioni del potenziale decorrono secondo una curva
esponenziale, diminuendo dapprima molto rapidamente, e poi, più lentamente con l'aumentare della distanza.55
7. Effetto di un flusso di corrente subliminale sulla eccitabilità
Per provocare un potenziale di azione, l'intensità della corrente che passa attraverso la membrana deve essere tale da ridurre il potenziale di membrana ad un determinato valore critico.
Le correnti di minore intensità determinano invece modificazioni irrilevanti dell'eccitabilità.
Per misurare le variazioni dell'eccitabilità, prodotte da uno stimolo elettrico subliminale, è necessario saggiare l'eccitabilità a vari intervalli di tempo, per mezzo di un secondo stimolo di intensità variabile.
Quando si applica ad una cellula un breve stimolo condizionante subliminale, l’intensità che lo stimolo test deve avere per generare un potenziale di azione diminuisce; aumenta cioè l'eccitabilità della cellula, e tale iper-eccitabilità persiste oltre la durata dello stimolo condizionante.
Questa persistenza è una conseguenza delle proprietà di condensatore della cellula, in quanto la variazione di voltaggio, gradualmente decrescente, permane oltre lo stimolo subliminale e può sommarsi alle variazioni di voltaggio determinate dallo stimolo test.
L'aumento dell'eccitabilità non è circoscritto alla sede del catodo condizionante, ma si estende da ambo i lati diminuendo con andamento esponenziale in condizioni di riposo rispetto al valore di soglia.
Se lo stimolo subliminale è prolungato all'inizio del flusso di corrente, l'eccitabilità a livello del catodo aumenta; successivamente, anche se la corrente costante continua a passare, l'eccitabilità diminuisce fino ad un valore intermedio stabile.
Tale diminuzione dal valore massimo dell'eccitamento, durante il passaggio di una corrente costante, viene detto accomodazione.
Dopo l'interruzione del flusso di corrente, l'eccitabilità al catodo diminuisce al di sotto del valore di riposo, e ritorna al valore normale solo lentamente; tale fenomeno viene indicato con il termine di depressione post-catodica.55
8. Variazioni della permeabilità ionica in rapporto con il potenziale di azione
I metodi di registrazione intracellulare permisero di constatare che durante l'eccitamento il potenziale di membrana non cade semplicemente a zero, ma si inverte, sicché l'interno della membrana diviene positivo rispetto all'esterno (overshoot).
Di conseguenza, Hodgkin avanzò l'ipotesi che il meccanismo fondamentale del potenziale di azione fosse costituito da una breve variazione altamente specifica della conduttanza (impedenza = reattanza + conduttanza) della membrana per gli ioni sodio (GNa), variazione che permette la migrazione di sodio nell'interno della cellula, per cui il potenziale di membrana si avvicina al potenziale di equilibrio per il sodio.
Più specificatamente, quando GNa aumenta e diviene maggiore della conduttanza per il potassio (GK), si ha una brusca e netta migrazione di ioni sodio nell'interno della cellula.
A determinare tale migrazione contribuiscono sia il potenziale di membrana interno negativo, sia la concentrazione di sodio, elevata all'esterno e bassa all'interno della cellula.
Il cospicuo aumento (500 volte) di GNa sembra essere in rapporto con la rapida riduzione del voltaggio di membrana determinata dallo stimolo.
Una volta che il voltaggio abbia raggiunto il valore soglia, l'aumentato flusso di ioni sodio all'interno provoca una ulteriore depolarizzazione, che, a sua volta, aumenta ulteriormente la conduttanza per il sodio, e così via.
L'aumento di GNa durante l'attività è transitorio, perciò GNa diminuisce verso il valore di riposo, nel termine di 1 msec.
Quando il potenziale di membrana è vicino a zero, o positivo, nell'interno comincia ad aumentare GK, se pure lentamente.
L'aumento della conduttanza per gli ioni potassio, e quindi la diminuzione della conduttanza per gli ioni sodio, concorrono entrambi a riportare rapidamente il potenziale verso il valore di riposo.
Dopo il ritorno del potenziale di membrana al valore di riposo, GK diminuisce al suo valore normale.
Questi due eventi limitano la durata del potenziale di azione, e determinano la ripolarizzazione della cellula.
9. Elettrofisiologia cardiaca
Presupposto necessario della contrazione della fibrocellula miocardica è la sua attivazione elettrica (accoppiamento eccitazione-contrazione).
In condizioni di riposo la cellula cardiaca presenta nel suo interno un potenziale negativo rispetto all’esterno, che varia a seconda del tipo di cellula tra -90 e -40 mV (v. fig. 1).
Tale differenza di potenziale è dovuta al fatto che la composizione ionica nei comparti intra ed extracellulari è profondamente diversa.
Ad esempio, in condizioni di riposo, la concentrazione del K+ è di gran lunga maggiore all’interno della cellula rispetto all’esterno (150 mEq contro 5 mEq) mentre il contrario avviene per il Na+ che è 10 volte più concentrato all’esterno che all’interno (140 mEq contro 14 mEq).
Analogamente gli anioni organici ed il Cl- prevalgono all’interno, al contrario del Ca ++.
Questa situazione è resa possibile dalla impermeabilità della membrana cellulare agli ioni che ne impedisce la diffusione passiva da un versante all’altro, fatta eccezione per appositi canali la cui conduttanza è variabile da ione a ione e da momento a momento.
L’attivazione elettrica della cellula miocardica, che può essere ottenuta sperimentalmente inviando un impulso elettrico dall’esterno, dà il via a modificazioni dinamiche del potenziale intra ed extracellulare che, se registrate graficamente, costituiscono il cosidetto potenziale d’azione.
Il potenziale d’azione si divide in quattro fasi principali (fig. 1):
La fase 0 corrisponde all’attivazione vera e propria e comporta una brusca riduzione della negatività intracellulare fino all’inversione della polarità.
La fase 0 è determinata da un massiccio e breve aumento della conduttanza al Na+ e Ca++ che inondano il comparto intracellulare.
Alla fase 0 seguono le fasi 1, 2 e 3 durante le quali avviene la ripolarizzazione cellulare cioè il ripristino della negatività intracellulare o fase 4.
Durante le fasi 1, 2 e 3 continua l’ingresso nelle cellule di Na+ e Ca++ mentre contemporaneamente fuoriesce in gran copia il K+.
Durante la fase 4 una pompa attiva provvede a scambiare una molecola di Na+ con una di K+ ripristinando il patrimonio intracellulare di K+ e riportando parallelamente all’esterno il Na+.
Alcune cellule (cellule automatiche) hanno la peculiarità di manifestare una progressiva riduzione del potenziale di riposo durante la fase 4 (depolarizzazione diastolica spontanea). Esse hanno capacità automatica perché quando il potenziale di riposo raggiunge un valore critico (potenziale soglia) scatta la fase 0 e la cellula si attiva autonomamente (fig. 2).
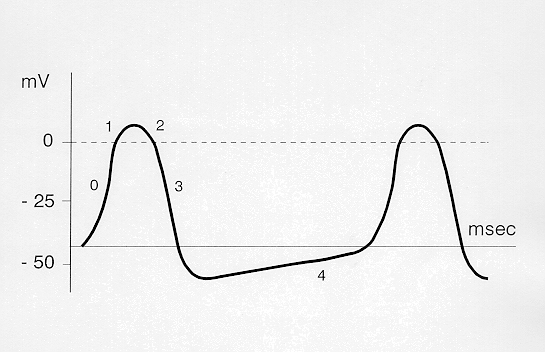
fig. 2 - Potenziale monofasico di una cellula automatica
La propagazione dell’impulso elettrico da una cellula all’altra (conduzione) si realizza perchè il brusco cambiamento di polarità extracellulare che consegue all’attivazione di una cellula fa da evento iniziatore per la depolarizzazione della cellula vicina.
Tra cellula attivata e cellula non attivata si crea infatti una contrapposizione di cariche che a sua volta determina una piccola corrente locale tra le due cellule (fig. 3). Ne deriva una riduzione della differenza di potenziale transmembrana della cellula inattiva che, al raggiungimento del potenziale soglia, fa scattare la fase 0 del potenziale di azione.
La fig. 3 rappresenta schematicamente un piccolo lembo di tessuto miocardico con tre cellule.
La propagazione dell’impulso avviene grazie ai movimenti di cariche elettriche provocati dalla differenza di potenziale che si crea tra cellula attivata e cellula a riposo. Infatti la cellula attivata presenta all’esterno un potenziale negativo, mentre quella inattivata ha un potenziale positivo.

fig. 3 - Rappresentazione schematica di un piccolo lembo di tessuto miocardico con tre cellule
La velocità di propagazione dell’impulso (velocità di conduzione) varia in aree diverse del cuore ed è direttamente correlata con la pendenza della fase 0 delle cellule che compongono quelle aree.
Cellule con fase 0 ripida hanno alta velocità di conduzione, cellule con fase 0 lenta hanno bassa velocità di conduzione. La ripidità della fase 0 è a sua volta correlata con il potenziale di riposo secondo la curva di Wiedman: più negativo il potenziale di riposo, più ripida la fase 0 e viceversa.
Le fibrocellule cardiache possono essere schematicamente divise in due tipi fondamentali: le fibre rapide e le fibre lente (fig. 4).
Le fibre rapide sono dislocate nel miocardio atriale, in quello ventricolare, nel sistema di conduzione His-Purkinje; quelle lente sono indovate nel nodo del seno e nel nodo AV.
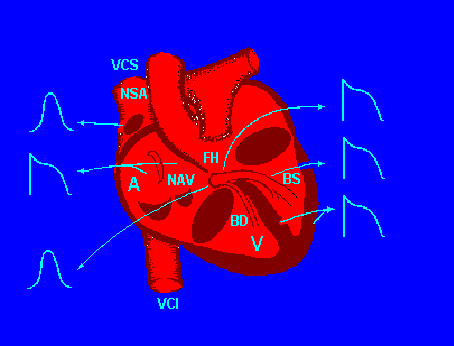
fig. 4 - Rappresentazione della diversa dislocazione delle fibre rapide e lente
Le prime, Na+ dipendenti, hanno un potenziale di riposo di -80¸-90 mV, fase 0 ripida ed ampia e conseguentemente alta velocità di conduzione.
Appartengono a questa categoria le fibrocellule atriali, le ventricolari e quelle del sistema His-Purkinje.
Le seconde hanno potenziale di riposo di -40¸-70 mV, fase 0 lenta e conseguente scarsa velocità di conduzione. Le fibre lente sono Ca++ dipendenti, cioè durante la fase 0 prevale l’ingresso intracellulare del calcio.
Appartengono a questo gruppo le cellule del nodo del seno e quelle che costituiscono il corpo del nodo A-V.
In condizioni patologiche, fibre rapide possono perdere la capacità di ripolarizzarsi completamente, raggiungere un potenziale di riposo meno negativo del normale e trasformarsi in fibre lente.
L’eccitabilità delle cellule miocardiche è un fenomeno limitato nel tempo; infatti, dopo l’attivazione (fase 0), la cellula diventa refrattaria per un periodo di tempo più o meno lungo.
Più precisamente, il periodo durante il quale la cellula, se stimolata, non dà origine ad alcuna risposta elettrica propagabile viene definito periodo refrattario assoluto (PRA). Si definisce invece periodo refrattario relativo (PRR) il periodo durante il quale la cellula, se stimolata, dà origine ad un potenziale di azione con fase 0 più lenta e minore voltaggio.
Infine, dopo il completamento del PRR, esiste un tempuscolo (fase supernormale di eccitabilità) durante il quale la cellula risponde anche a stimoli generalmente subliminali. La somma del periodo refrattario effettivo, del periodo refrattario relativo e della fase supernormale costituisce il periodo refrattario totale. Il periodo refrattario totale corrisponde alla somma delle fasi 1, 2 e 3.
In cellule patologiche il periodo refrattario può andare anche molto oltre la fase 3. In tali cellule inoltre può ampliarsi la forbice tra periodo refrattario relativo ed effettivo; questo fenomeno può facilitare la conduzione lenta di impulsi prematuri ed a sua volta determinare aritmie da rientro.
Nella fig. 5 è rappresentato schematicamente il potenziale di azione monofasico con i periodi refrattario assoluto (PRA) e con la fase supernormale (FSN).
Durante il PRA la cellula non è eccitabile; durante il PRR la cellula è eccitabile ma il potenziale di azione evocato ha una fase 0 meno ampia; durante la FSN stimoli generalmente subliminali (e quindi inefficaci) riescono ad eccitare la cellula.

fig. 5 - Rappresentazione schematica di potenziale d’azione monofasico con i periodi refrattari assoluto (PRA) e relativo (PRR) e con la fase supernormale (FSN)
10. Attivazione cardiaca normale
In condizioni di normalità, il ritmo cardiaco viene scandito dal nodo del seno, struttura localizzata in atrio destro laterale alto all’imbocco della vena cava superiore (fig. 6).
L’impulso che nasce dal nodo del seno si diffonde agli atri in modo relativamente omogeneo con un fronte d’onda che ricorda quello generato da un sasso gettato in una pozza d’acqua.
La propagazione dell’impulso elettrico ai ventricoli avviene attraverso un passaggio obbligato.
Normalmente infatti gli atri sono isolati elettricamente dai ventricoli per l’interposizione di una struttura fibrosa, il trigono fibroso.
L’unica comunicazione è rappresentata dal sistema nodo-Hisiano che perfora il trigono fibroso a livello del setto interatriale nella parte anteriore del triangolo di Kock.

fig. 6 - Rappresentazione schematica dell’attivazione cardiaca
Quindi l’impulso che nasce dal nodo del seno (NSA) arriva ai ventricoli, dopo aver attraversato il miocardio atriale e percorso il sistema nodo-Hisiano (nodo A-V, fascio di His FH, branca destra BD). Il sistema nodo Hisiano è localizzato nel triangolo di Koch; quest’ultimo è un triangolo rettangolo ideale nel quale i due cateti sono rappresentati dal bordo settale della tricuspide (VT) e dal breve tratto che va dall’imbocco del seno coronarico (SC) allo stesso bordo della tricusoide. L’ipotenusa è il segmento che unisce il fascio di His all’imbocco del seno coronarico.
Nella figura sono inoltre schematizzate le due vie di accesso dell’impulso elettrico al nodo A-V: la via veloce (in alto, vicino alla giunzione nodo-Hisiana) e la via lenta (di fronte all’imbocco del seno coronarico).
E’ tuttora controversa la modalità con cui il nodo A-V viene attivato dal fronte d'onda proveniente dagli atri.
A differenza di quanto ritenuto in passato, probabilmente il nodo A-V non è attivabile lungo tutto il suo perimetro ma ha delle vie d’ingresso e d’uscita preferenziali. Una via d’ingresso è certamente localizzata nella zona di passaggio tra nodo A-V e fascio di His nella parte anteriore del triangolo di Kock; in molti casi esiste una seconda via d’approccio nella parte posteriore del triangolo di Kock.
La prima ha una velocità di conduzione relativamente rapida (via veloce), la seconda è nettamente meno rapida (via lenta) come mostrato in fig. 6.
In alcuni soggetti normali l’esistenza delle due vie è stata dimostrata casualmente durante uno studio elettrofisiologico endocavitario.
In tali casi le due vie avevano una refrattarietà diversa ed è stata ottenuta in momenti diversi la conduzione alternata attraverso l’una o l’altra via.
Più precisamente, durante la stimolazione ventricolare destra è stato visto che se la conduzione avveniva attraverso la via veloce l’impulso emergeva in atrio vicino al fascio di His; quando invece conduceva la sola via lenta l’impulso emergeva in atrio di fronte all’imbocco del seno coronarico.
Il nodo A-V continua con il fascio di His che a sua volta si biforca nelle due branche, la destra e la sinistra, destinate ai rispettivi ventricoli.
La branca sinistra dopo un breve tratto si divide in due fascicoli principali, l’anterosuperiore ed il posteroinferiore. La branca destra ed i fascicoli della branca sinistra si ramificano in ramuscoli più sottili di cui è difficile ricostruire il decorso con le normali tecniche istologiche ma che possiamo immaginare come le appendici terminali di un albero che si ramifica progressivamente fino alle foglie.
L’impulso che si diparte dal nodo del seno ha lungo tutto il suo tragitto una velocità di conduzione relativamente uniforme, fatta eccezione per il nodo A-V dove il suo cammino subisce un critico rallentamento.
Tale rallentamento, la cui durata copre gran parte dell’intervallo PR, permette la netta separazione tra contrazione atriale e ventricolare e quindi fa sì che la contrazione atriale possa completarsi prima della sistole ventricolare e della conseguente chiusura delle valvole atrioventricolari.
Il nodo del seno è il pacemaker primario del cuore: esso possiede una propria frequenza intrinseca che può essere messa in evidenza denervando chirurgicamente o farmacologicamente il cuore.
La frequenza cardiaca intrinseca è variabile da soggetto a soggetto e si riduce con l’età.
La frequenza cardiaca intrinseca teorica di ogni soggetto può essere calcolata in base ad una formula proposta da Jose così espressa:
FCI = 118,1 - (0,57 x età del paziente)
Si considerano entro la norma le differenze rispetto alla media teorica del 14% prima dei 45 anni e del 18% dopo i 45 anni.
Ad esempio, in un soggetto di 30 anni, la frequenza cardiaca intrinseca dovrebbe essere pari a 118,1 - (0,57x30) = 101 bpm con oscillazione in più o meno di 14 bpm.
In un soggetto di 60 anni invece la frequenza cardiaca intrinseca dovrebbe essere pari a 118,1 - (0,57x60) = 84 bpm con oscillazioni in più o in meno di 15 bpm.
In realtà la frequenza cardiaca basale è abitualmente inferiore a quella intrinseca del nodo del seno a causa del freno posto dal vago che a riposo ha una pressione costante e prevale sul simpatico. La reazione d’allarme e lo sforzo determinano un’attivazione del simpatico ed il rilascio ematico di catecolamine che, eliminando la prevalenza vagale, accelerano la frequenza cardiaca.
Il sistema nervoso autonomo innerva riccamente, oltre al nodo del seno, anche il miocardio atriale ed il nodo atrioventricolare.
Sul miocardio, il vago ed il simpatico hanno un’azione simile cioè ambedue, quando attivati, ne accorciano il periodo refrattario.
Sul nodo A-V invece hanno un’azione opposta; il vago rallenta la velocità di conduzione e aumenta il periodo refrattario, incrementando quindi la capacità di filtro della struttura nodale; il simpatico viceversa accorcia il periodo refrattario e aumenta la velocità di conduzione.
I ventricoli, secondo alcuni Autori, sarebbero innervati soltanto dal simpatico che avrebbe effetti simili a quelli sul miocardio atriale.
Oltre al nodo del seno, esistono altre strutture dotate di automatismo fisiologico, definite pacemaker ausiliari. Esse sono localizzate nella giunzione nodo-Hisiana e nelle branche e hanno una frequenza di scarica inferiore a quella del nodo del seno.
Normalmente non entrano in funzione perchè sono costantemente depolarizzati dal ritmo sinusale prima che essi raggiungano la soglia di eccitabilità. In caso di depressione della funzione sinusale possono entrare in funzione ed assumere il comando del ritmo cardiaco.