I GAS
di
Massimo Fantinmarzo 2000
Questo ipertesto è nato dalla riflessione sul fatto che i gas sono costituiti da un gran numero di molecole in moto disordinato l’una rispetto all’altra, ogni molecola viene pensata come una pallina che si muove secondo le leggi della meccanica classica, urta contro altre molecole e contro le pareti del recipiente con urti elastici. Ho voluto costruire concretamente un modello di gas che fosse facile da osservare e che fosse possibile misurare le grandezze termodinamiche e verificare su di esso le leggi studiate teoricamente.
Il modello che viene presentato è leggermente diverso da quello che si studia in termodinamica classica infatti le molecole sono rappresentati da dischi (oggetti bidimensionali) e si muovono in una porzione di piano (un rettangolo). Mentre nella teoria cinetica classica le molecole si muovono in una porzione di spazio tridimensionale. Questa semplificazione fa si che le formule qui studiate differiscano da quelle classiche, come si vedrà nella trattazione teorica, in particolare: Il volume è, nel nostro modello una superficie tuttavia continueremo a indicalo con la lettera V.
L'aspetto interessante è che il programma tiene sotto controllo le grandezze microscopiche (velocità e posizione ) di tutte le molecole e le grandezze macroscopiche misurate (volume, pressione e temperatura ) dipendono dalle corrispondenti grandezze microscopiche. Questa particolare costruzione fa si che esista una certa instabilità nelle grandezze misurate, Il motivo sta nell'esiguo numero di molecole di cui è costituito il gas. Cento sono molto poche rispetto al numero di molecole di cui è costituito un gas reale, tuttavia è possibile effettuare delle misure significative.
Vista la instabilità delle grandezze termodinamiche è necessario effettuare molte misure e considerare le medie e gli scarti indicheranno le incertezze.
Per lo studio teorico si procede in modo analogo a come si fa nella teoria classica della cinetica dei gas.
Il gas è formato da n molecole di massa m che si suppongono circolari, in moto casuale, si urtano fra di loro e urtano contro le pareti del recipiente, tre pareti sono fisse mentre una è mobile ( stantuffo).
Quando una molecola si scontra contro una parete fissa la componente della quantità di moto nella direzione normale alla superficie inverte di direzione mentre rimane invariata la componente nella direzione parallela alla superficie ( urto elastico contro una parete di massa infinita), questa variazione della quantità di moto si traduce in una forza e quindi in una pressione .
Per calcolare la pressione esercitata da ogni molecola di un gas contro le pareti del recipiente calcoliamo la forza come variazione della quantità di moto rispetto al tempo;
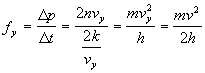
essendo supposto le velocità medie lungo le due direzioni siano uguali e che
![]()
dove l e h rappresentano l’altezza e la larghezza del contenitore, v la velocità e vx, vx le componenti della velocità lungo x e y.
La pressione esercitata da tutte le n molecole sarà pertanto:
![]()
dove U rappresentano l'energia interna e V il volume (la superficie).
La pressione si calcola anche come rapporto tra la forza peso dello stantuffo e la sua lunghezza:
![]()
dove M rappresenta la massa dello stantuffo, g l'accelerazione di gravità.
Da cui si ricava che l'equilibrio si raggiunge quando U= h M g.
La temperatura viene definita come l'energia cinetica media delle molecole
T=U / n.
L'equazione del gas perfetto, per quanto detto è pertanto:
P V = n T
Si osserva quindi che il valore della costante di Boltzmann dei gas, nel nostro modello è uno, inoltre non si parla di moli ma di molecole pertanto non ha senso parlare della costante R.
Le unità di misura delle grandezze fisiche sono arbitrarie,
Trasformazioni isobare e isoterme
Possiamo, analogamente a come si fa per i gas, considerare le trasformazioni Isotermiche, Isocore, isobare per le quali valgono le note leggi dei gas.
Anche i lavori compiuti durante le suddette trasformazioni assumono i soliti valori:
Trasformazione isobara
L = P (V2-V1)
Trasformazione isoterma
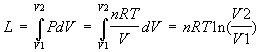
nel nostro modello:
L = n T ln ( V2/V1 )
Sono quelle trasformazioni nelle quali non si ha scambio di calore, come è noto la per esse vale la relazione: P V y
= costante dove y = c p / c vPer calcolare il valore di gamma nel nostro modello procediamo analogamente a come si fa in termodinamica, calcoliamo le capicità termiche a volume costante e a pressione costante.
Cv = dQ/dT = dU/dT perché essendo una trasformazione a volume costante il lavoro è zero e dal primo principio segue che dQ=dU.
Ma essendo U=nT si avrà che cv=d nT/dT=n.
Cp= dQ/dT= (dU+dL)/dT= n+ dL/dT= n+d PV/dT= n+d nT/dT=n+n=2n.
I calori specifici saranno riferiti a una molecola e varranno rispettivamente 1 e 2.
Pertanto il rapporto tra i calori specifici y = 2 e l'equazione della adiabatica nel nostro modello è
P V 2 = P0 V02
Il lavoro prodotto in una trasformazione adiabatica si calcola
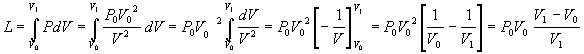
Se una molecola P1 con velocità v1 urta una molecola P2 con velocità v2, per trovare le velocità dopo l'urto si consideri il piano (retta) tangente alle palline nel punto di contatto, le quantità di moto si scompongono nelle direzioni parallele e perpendicolare al piano, le componenti parallele vengono conservate dalle particelle mentre le componenti perpendicolari vengono scambiate. E' facile verificare che in questo modo si conservano sia la quantità di moto totale ( la somma delle quattro componenti rimane la stessa) che l'energia cinetica ( la somma dei quadrati delle quattro componenti rimane pure la stessa).
La particella di massa m che urta contro lo stantuffo di massa M conserva la componente orizzontale della quantità di moto mentre interferirà per quanto riguarda la componente verticale. Per la quale è possibile risolvere facilmente il problema applicando la conservazione della quantità di moto e dell'energia cinetica; posti v1 e V1 le velocità iniziali della particella e dello stantuffo e v2 e V2 le velocità dopo l'urto , risolvendo il sistema
MV1 + m v1 = MV2 + m v2
MV1 2+ m v1 2= MV2 2+ m v22
Si ottiene:
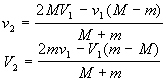
che esprimono le componenti verticali delle velocità dopo l'urto.
Per calcolare la posizione dello stantuffo in un istante di tempo successivo si dovrà tener conto che il moto di esso è accelerato dalla gravità, pertanto la sua posizione e la sua velocità dopo un tempo
D t saranno:Y2=Y1+V1
D t - 1/2g D t2V2=V1-g
D tDove V1 Y1 rappresentano la posizione e la velocità iniziale dello stantuffo mentre V2 Y2 quelle finali
E' facile verificare che anche queste ultime trasformazioni conservano l'energia totale dello stantuffo infatti la diminuzione di energia cinetica dovuta all'accelerazione di gravità viene immagazzinata sotto forma di energia potenziale.
In generale l'energia totale del sistema che si conserva nelle trasformazioni adiabatiche è data da:
ETot= U + 1/2Mv2 + Mgh.
Nelle trasformazioni isobare in comportamento è simile con la sola differenza che in queste ultime si agisce sulla temperatura pressione mentre nelle prime sulla pressione.
Nelle trasformazioni isoterme rimane costante l'energia interna U pertanto se il gas si espande l'energia potenziale acquisita dallo stantuffo non si ottiene a scapito dell'energia interna delle molecole che rimane la stessa ma viene fornita dal termostato. L'energia totale non si conserva infatti si ha uno scambio di calore.
Il
programma di simulazione (applet java ) calcola ad ogni intervallo di tempo D t la posizione di ogni particella a partire dalla velocità e dalla posizione precedente secondo le formule del moto rettilineo uniforme:x = x + vx
D ty = y + vy
D tverifica se sono avvenuti degli urti fra particelle o se alcune particelle hanno urtato contro le pareti o contro lo stantuffo, in tal caso ricalcola le posizioni e le velocità come illustrato precedentemente e rappresenta le posizioni delle particelle, dello stantuffo e i valori dei parametri, in particolare calcola:
U =1/2 m n
S v2T = U / n
V = l * h
P=U / V
L = L0 + P (V-V0)
Q = Q 0 + (U-U0) - ( L - L0)
S = S0+ (Q-Q0) / T
Significato dei comandi
La
prima finestra a sinistra consente di selezionare il tipo di trasformazione; a seconda del tipo di trasformazione si può agire solo su una grandezza fisica, la stessa sulla quale si agirebbe se si volesse realizzare una trasformazione reale, (i tasti permessi sono verdi mentre quelli proibiti sono rossi ):per eseguire una trasformazione isoterma o adiabatica si agisce sulla massa dello stantuffo ( tasti M+, M-)
per le trasformazioni isocora o isobara si agisce sui tasti (T+, T- )
La
seconda finestra consente di scegliere la massa delle singole particelle, m da 1 a 4.I tasti
T+ T- consentono di modificare la temperatura della sorgente ( trasformazioni isobara e isocora)I tasti
M+ M- consentono di modificare la massa dello stantuffo che viene scritta nella casella, il valore di M non entra mai nei calcoli tuttavia è scritto per comodità dell'operatore nel caso voglia ritornare ad uno stato iniziale. (trasformazioni isoterme e adiabatica).I tasti
ing e rimp permettono di ingrandire o rimpicciolire le molecole, tra di esse si trova il valore del covolume ovvero del volume occupato dalle molecole.I tasti
N- N+ consentono di diminuire o aumentare il numero delle molecole contenute nel cilindro, le molecole che vengono introdotte nel recipiente entrano in basso a sinistra alla temperatura del gas.I tasti
Q=0, L=0,S=0 consentono di azzerare le scale del calore, del lavoro e dell'entropia.Nella parte sinistra sono vivibili le molecole che si muovono all'interno del recipiente e urtano tra di loro e contro le pareti.
Nella parte destra si trovano sei scale graduate che permettono di leggere
Il
Volume V in corrispondenza del limite inferiore dello stantuffo.La Temperatura T
Il
calore assorbito Q ( lo zero è centrale per poter misurare calori entranti positivi e calori uscenti negativi) Il calore è espresso in kilo unità.Il
lavoro prodotto L ( lo zero è centrale per poter misurare lavori fatti positivi e lavori subiti negativi) il lavoro è espresso in kilo unità.Entropia
S ( anche qui lo zero è centrale ) il lavoro è espresso in etto unità.I valori numerici di queste grandezze vengono anche scritti in alto per comodità e per consentirne la lettura anche nel caso le misure esulino dalle scale graduate.
Tutte le misure vanno effettuate in condizioni di equilibrio, tuttavia anche in questo caso permangono delle fluttuazioni inevitabili. Conviene effettuare più misure nelle stesso stato, assumere come valore più probabile il valore medio e come incertezza le scarto quadratico medio.
Verifica delle leggi dei gas
![]() Verifica della legge di Gay Lussac
Verifica della legge di Gay Lussac
![]() Verifica della legge di Avogadro della invarianza dei volumi
Verifica della legge di Avogadro della invarianza dei volumi
![]() Verifica della legge del gas perfetto
Verifica della legge del gas perfetto
Calcolo del lavoro prodotto in una trasformazione
Macchine termiche
Esercitazione
Verifica delle leggi dei gas
Legge di Boyle
Nelle trasformazioni isoterme pressione e volume sono direttamente proporzionali
P V = costante
Per verificare questa legge posizionare il selettore in isoterma, scegliere il minimo raggio delle molecole, portare lo stantuffo nella parte alta del cilindro, attendere che il sistema sia in equilibrio, prendere nota dei valori di P e di V, ripetere la misura più volte nello stesso stato e calcolare la media dei prodotti PV e lo scarto quadratico medio che indica la semiampiezza dell'intervallo di incertezza. Aumentare la pressione, agendo su M+ qualche volta ma lentamente, attendere che il sistema si riposizioni in equilibrio, prendere nota dei valori di P e di V, Ripetere l'operazione più volte come in precedenza. Verificare che i gli intervalli di incertezza dei valori medi di PV ottenuti ammettano un'intersezione comune.
Nelle trasformazioni isobare la temperatura e il volume sono direttamente proporzionali:
V / T =costante
Si procede in modo analogo alla legge di Boyle con la sola differenza che per le trasformazioni isobare si modifica la temperatura e che la legge è di proporzionalità diretta anziché inversa.
Secondo La legge di Avogadro il volume occupato dal gas non dipende dal tipo di gas ma solo dalla pressione, dalla temperatura.
Si effettua la misura dei parametri termodinamici P,V,T in condizioni di equilibrio, si cambia il gas, scegliendo nella seconda finestra un altro valore di m, e si verifica che a parità di pressione e temperatura il volume non è cambiato, anche in questo caso effettuare più misure nello stato di equilibrio e calcolare il valore medio e lo scarto. Verificare infine che i volumi trovati hanno una intersezione comune.
Legge dei gas perfetti
P V = n k TSecondo la teoria esposta, per come sono state definite le grandezze del modello il valore di k vale 1 ed n indica il numero di molecole.
Si lascia allo studente la ricerca del metodo per la verifica, in particolare si verifichi che il valore di k è 1.
Rispetto all'equazione dei gas perfetti, questa legge tiene conto delle dimensioni delle molecole che non risultano trascurabili rispetto alla grandezza del recipiente, La legge di Clausius ( semplificazione dell'equazione di Van der Valls
) tiene conto del volume occupato dalle molecole (covolume) e si scriveP(V-b)=nT
Per verificare questa legge si può possono rifare le misure eseguite per la legge dei gas ripetendole con diverse dimensioni delle molecole. Si osserverà che , se le dimensioni delle molecole non sono trascurabili rispetto a quelle del recipiente è bene tenerne conto con questa correzione.
Misura dei calori specifici a pressione costante e a volume costante
Per determinare il calore specifico a pressione costante si deve selezionare la trasformazione adiabatica, azzerare il valore del calore premendo il tasto Q = 0,tenere conto delle temperatura iniziale, effettuare la trasformazione modificando la temperatura, prendere nota del nuovo valore di temperatura e del calore, calcolare il rapporto tra il calore e la differenza delle temperature, quello che si trova è la capacità termica del gas, dividere infine per il numero delle molecole n. Ripetere diverse volte l'operazione e calcolare la media e lo scarto, verificare che il valore trovato teoricamente rientra nell'intervallo di incertezza errore trovato sperimentalmente.
Per determinare il calore specifico a volume costante si procede analogamente al caso precedente con la sola differenza che occorre selezionare la trasformazione isobara e che il valore teorico è differente
.
Costante gamma dei gas perfetti
Dal calcolo teorico è risultato che nel nostro modello il valore di gamma è due. Per verificarlo sperimentalmente è sufficiente effettuare una trasformazione adiabatica e annotare i valori di P e di V iniziali, intermedi e finali, infine calcolare i prodotti PV 2 e verificare che, nei limiti degli errori, coincidono. Verificare inoltre che il valore di gamma coincide con il rapporto tra i calori specifici del gas, misurati precedentemente.
Calcolo del lavoro prodotto in una trasformazione Isobara
Il lavoro prodotto da una trasformazione isobara è dato da
L = P (V2-V1)per verificarla si posizioni il selettore nella "isobara" si attende che il sistema raggiunga l'equilibrio, si azzera il lavoro con il tasto "L=0", e si prende nota del valore di V, e agendo sui tasti della temperatura si giunge ad un'altra posizione di equilibrio, si annota il valore di V e quello di L, si calcola La differenza dei volumi e si verifica la condizione scritta in alto. Anche in questo caso è necessario ripetere l'operazione più volte e calcolarne i valori medi.
Calcolo del lavoro prodotto in una trasformazione Isoterma
Il lavoro prodotto da una trasformazione isoterma è dato da L = n k T ln ( V2 / V1 ), nel nostro modello n indica il numero delle molecole ed k vale 1.
Per verificare questa legge posizionare il selettore nella posizione di isoterma, prendere nora dei valori di V,T, azzerare il lavoro, effettuare una trasformazione , riprendere nota dei valori e verificare la validità della legge.
Calcolo del lavoro prodotto in una trasformazione Adiabatica
Nella trasformazione adiabatica, come si è dimostrato teoricamente , per il nostro modello il lavoro è dato da
L=P1 V12 (1 / V1 - 1 / V2)
Si lascia allo studente la verifica da farsi in modo analogo al caso precedente.
Si posizioni lo stantuffo in alto, si aspetti di raggiungere l'equilibrio termico, si prenda nota dei valori di P,T,V, si azzerino il lavoro, il calore e l'entropia.
Si selezioni la trasformazione isoterma, aumentando la pressione lentamente, affinché la trasformazione sia quasistatica si giunga a raddoppiare la pressione, si prenda nota dei valori di V,P,T,Q,L,S ( si noti che il valore di Q letto corrisponde aQ1 cioè al calore ceduto alla sorgente fredda e sarà negativo perché uscente).
Si selezioni la trasformazione adiabatica e, aumentando la pressione si quadruplichi la pressione ( fino a renderla otto volte quella di partenza) si prenda nota dei valori come sopra ( si commentino i valori assunti dai parametri)
Si selezioni nuovamente la trasformazione isoterma e diminuendo la pressione si giunga fino dimezzare la pressione ( deve essere quattro volte quella iniziale) si prenda noto dei valori e si commentino (il valore di Q2, calore assorbito è dato dalla variazione del valore di Q durante questa trasformazione isoterma )
Si selezioni la trasformazione adiabatica e si diminuisca ancora la pressione fino a giungere al valore iniziale, si prenda nota dei valori ottenuti. Si leggano anche i valori di L, di Q e di S e si verifichi:
Il primo principio della termodinamica Q = L Perché al termine del ciclo l'energia interna ha lo stesso valore iniziale.
Il secondo principio, in particolare l'entropia della trasformazione ciclica è zero e
Il rendimento della macchina di Carnot
h = 1 -- Q1 / Q2 = 1 -- T1 / T2Si rappresenti il ciclo ottenuto su un grafico e si verifiche graficamente che il lavoro è dato dall'area della parte di piano racchiusa dal grafico.
Si commentino personalmente i risultati ottenuti
Si posizioni lo stantuffo in alto, si aspetti di raggiungere l'equilibrio termico, si prenda nota dei valori di P,T,V, si azzerino il lavoro, il calore e l'entropia.
Si selezioni la trasformazione isoterma, aumentando la pressione lentamente, affinché la trasformazione sia quasistatica si giunga a raddoppiare la pressione, si prenda nota dei valori di V,P,T1,Q,L,S ( si noti che il valore di Q letto corrisponde aQ1 cioè al calore ceduto alla sorgente fredda e sarà negativo perché uscente).
Si selezioni la trasformazione isocora e, aumentando la temperatura si giunga ad un nuovo valore di temperatura T2 si prenda nota dei valori come sopra ( si commentino i valori assunti dai parametri)
Si selezioni nuovamente la trasformazione isoterma e diminuendo la pressione si giunga fino al valore di pressione di partenza, si prenda noto dei valori e si commentino (il valore di Q2, calore assorbito è dato dalla variazione del valore di Q durante questa trasformazione isoterma )
Si selezioni la trasformazione isocora e si diminuisca ancora la temperatura fino a giungere al valore iniziale, si prenda nota dei valori ottenuti. Si leggano anche i valori di L, di Q e di S e si verifichi:
Il primo principio della termodinamica Q = L Perché al termine del ciclo l'energia interna ha lo stesso valore iniziale.
Il secondo principio, in particolare l'entropia della trasformazione ciclica è zero e
Il rendimento della macchina reversibile
h = 1 -- Q1 / Q2 = 1 -- T1 / T2Si rappresenti il ciclo ottenuto su un grafico e si verifiche graficamente che il lavoro è dato dall'area della parte di piano racchiusa dal grafico.
Si commentino personalmente i risultati ottenuti
Il ciclo Otto viene considerato in modo ideale; come se fosse realizzato da un motore reversibile, pertanto non è una vera rappresentazione del ciclo reale del motore a scoppio, in particolare consideriamo solo le fasi cicliche: adiabatiche ed isocore, senza prendere in considerazione l'aspirazione e l'espulsione.
Si posizioni lo stantuffo in alto, si aspetti di raggiungere l'equilibrio termico, si prenda nota dei valori di P,T,V, si azzerino il lavoro, il calore e l'entropia.
Si selezioni la trasformazione adiabatica, aumentando la pressione lentamente, affinché la trasformazione sia quasistatica si giunga a raddoppiare la pressione, si prenda nota dei valori di V,P,T1,Q,L,S ( si noti che il valore di Q letto corrisponde aQ1 cioè al calore ceduto alla sorgente fredda e sarà negativo perché uscente).
Si selezioni la trasformazione isocora e, aumentando la temperatura si giunga ad un nuovo valore di temperatura T2 si prenda nota dei valori come sopra ( si commentino i valori assunti dai parametri)
Si selezioni nuovamente la trasformazione adiabatica e diminuendo la pressione si giunga fino al valore di pressione di partenza, si prenda noto dei valori e si commentino (il valore di Q2, calore assorbito è dato dalla variazione del valore di Q durante questa trasformazione isoterma )
Si selezioni la trasformazione isocora e si diminuisca ancora la temperatura fino a giungere al valore iniziale, si prenda nota dei valori ottenuti. Si leggano anche i valori di L, di Q e di S e si verifichi:
Il primo principio della termodinamica Q = L Perché al termine del ciclo l'energia interna ha lo stesso valore iniziale.
Il secondo principio, in particolare l'entropia della trasformazione ciclica è zero e
Il rendimento della macchina termica
h = 1 -- Q1 / Q2Si rappresenti il ciclo ottenuto su un grafico e si verifiche graficamente che il lavoro è dato dall'area della parte di piano racchiusa dal grafico.
Si commentino personalmente i risultati ottenuti