|
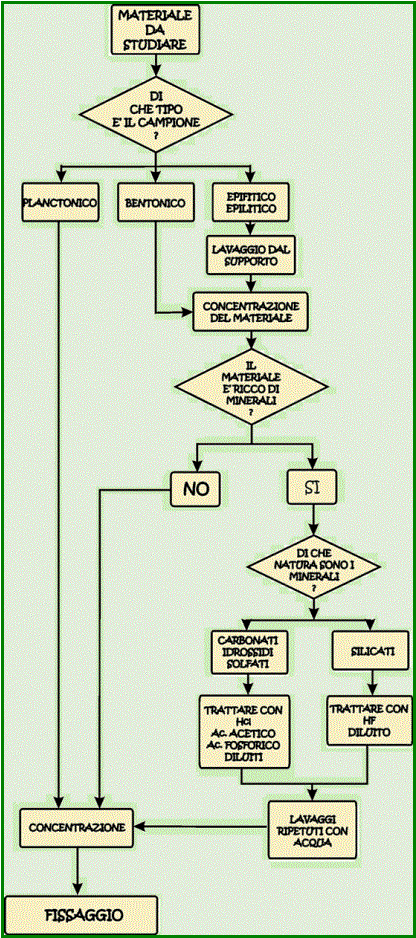
Per la maggior parte dei casi il materiale appena raccolto
può essere immediatamente fissato, ma talvolta risulta necessario manipolarlo
per poter concentrare gli esemplari. La preparazione dei campioni spesso è
necessaria quando si ha a che fare con campioni epifitici, vale a dire quando
si vuole raccogliere e studiare alghe che vivono sopra a foglie e fusti
sommersi o su muschi. In questi casi è necessario prendere le foglie (Nimphea,
Nuphar, Potamogeton, Ranunculus, Sphagnum, ecc.) e lavarle con
acqua. Allo scopo risulta utile una bassa bacinella nella quale il materiale
da lavare viene immerso in non più di un litro di acqua e lasciato a riposare
per qualche decina di minuti. Il materiale viene rimestato più volte Se si ha a che fare con muschi travertinizzati, o
comunque concrezionati da depositi di calcite, è necessario trattare le
fronde o i cuscini muscinali con
degli acidi capaci di sciogliere il calcare. Possono essere usati,
opportunamente diluiti, l’acido fosforico, l’acido acetico (si può utilizzare
anche il semplice aceto da tavola) o, con opportune precauzioni, anche
l’acido cloridrico (in quest’ultimo caso la macerazione dei muschi
concrezionati deve essere fatta all’aperto o sotto cappa aspirante per
evitare i danni di vapori emanati dall’acido). La reazione degli acidi con il
calcare provoca, se quest’ultimo è abbondante, una vistosa produzione di
schiuma che può essere abbattuta spruzzandoci sopra, con un vaporizzatore,
del comune alcol etilico denaturato. Il materiale raccolto a fine reazione
viene filtrato e concentrato secondo quanto illustrato in precedenza. Se il
materiale minerale da eliminare è di natura silicatica si dovrebbe ricorrere
all’acido fluoridrico. IN QUESTO CASO L’ATTENZIONE DEVE ESERE MASIMA PERCHE’
QUESTO REAGENTE E’ ESTREMAMENTE PERICOLOSO ED INOLTRE AGGREDISCE L’impiego di acidi per eliminare la frazione minerale può
essere fatto anche su campione già fissato, purché il fissativo venga prima
allontanato mediante ripetuti lavaggi con acqua, in modo che non si
verifichino reazioni pericolose per l’operatore. Gli acidi devono essere impiegati solamente in casi
estremi, quando la componente minerale del campione risulta troppo abbondante
per poter affrontare un significativo conteggio degli esemplari, perché,
oltre ad essere in alcuni casi pericoloso, porta ad un evidente
deterioramento dei cloroplasti che risultano talvolta fondamentali per la
determinazione degli esemplari. Il fissaggio del materiale appena raccolto,
preventivamente liberato da un’eventuale eccessiva componente minerale, viene
generalmente effettuata con una soluzione di aldeide formica (formalina) al
20-30% che può essere acquistata in farmacia. Si aggiunge al materiale da
fissare un quantitativo uguale di formalina al 20-30% nella quale nella quale
sia stato aggiunto un po’ di bicarbonato di sodio, NaHCO3, o,
meglio, di nitrato di rame, Cu(NO3)2 (circa un grammo
dell’uno o dell’altro per ogni 100 cc di formalina). Queste sostanze hanno la
funzione di tamponare l’acidità della formalina e di migliorare la
conservabilità dei cloroplasti, sia nella forma sia nella colorazione. I campioni così preparati possono essere conservati per
molti anni, purché il liquido di conservazione non evapori. Quando il campione conservato viene preparato per lo
studio deve essere lavato affinché la formalina (TOSSICA) venga allontanata e
non vengano inalati i suoi vapori. Esistono altri liquidi fissativi (alcol etilico o fissativo di Lugol), ma la formalina con nitrato di rame è quello che assicura i migliori risultati, sia immediati sia a lungo termine. |
|
|