|
Legame ionico |
Questo tipo di legame si realizza quando si
legano elementi dalle proprietà chimiche molto diverse. Prendiamo come esempio
il sodio e il cloro. Il sodio è un metallo, solido a temperatura ambiente e
fortemente reattivo. Ha numero atomico 11, ha quindi 11 protoni e 11 elettroni,
ma solo 1 nel livello energetico più esterno. Per raggiungere la stabilità
deve perdere questo elettrone, raggiungendo gli otto elettroni nel livello
inferiore.
Il cloro è un gas, anche lui fortemente reattivo: ha numero atomico 17, il che
vuol dire che ha 17 protoni nel nucleo e 17 elettroni, di cui 7 nel livello
energetico più esterno. Deve acquistarne uno per essere stabile.
|
|
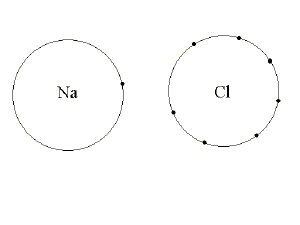
Qui di fianco sono disegnati i due atomi. A sinistra quello del sodio, con il suo elettrone esterno, e a destra quello del cloro con i suoi sette elettroni esterni. A questo punto tra i due atomi si realizza il trasferimento dell'elettrone, a causa dell'attrazione che il cloro esercita su quello del sodio, senza che questo si opponga alla sua perdita.
|
Ecco quello che accade:
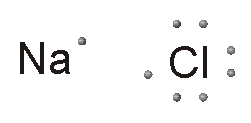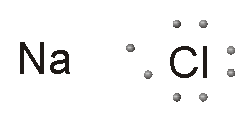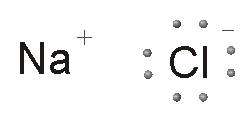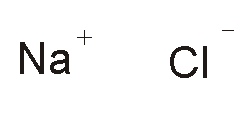 |
Quando questi due elementi si
legano fanno proprio questo: il sodio cede il suo elettrone al cloro. In
questo modo però si altera la neutralità elettrica dei due elementi: il
sodio avrà una carica negativa in meno e diventerà uno ione positivo. Il
cloro avrà una carica negativa in più e diventerà uno ione
negativo. Il legame ionico è quel legame elettrostatico che si realizza
tra ioni di segno opposto. Uno ione è un atomo che ha perso o acquistato uno o più elettroni. È positivo se ha perso elettroni, è negativo se li ha acquistati. |
L'elettrone del sodio viene catturato dal cloro; il sodio diventa
uno ione positivo e il cloro diventa uno ione negativo. Tra i due ioni si
stabilisce un'attrazione elettrostatica che terrà legati i due atomi nel
nuovo composto, il cloruro di sodio.
La struttura macroscopica del cloruro di sodio, a cristalli di forma
cubica, dipende dalla posizione che gli ioni sodio e cloro occupano nello
spazio.
Le proprietà dei composti ionici sono legate al modo con cui
gli ioni si legano.
I composti ionici sono solidi a temperatura ambiente, molto resistenti alla
compressione ma non alla trazione. Non sono conduttori di elettricità in quanto
le cariche elettriche (gli ioni) sono bloccati nel reticolo cristallino. Ma se
vengono sciolti in acqua, liberano gli ioni e la soluzione diventa conduttrice
(viene chiamata soluzione elettrolitica ogni soluzione in cui siano sciolti dei
sali).
I composti ionici non hanno una molecola vera e propria; la loro forma dipende dal numero degli ioni che si sono uniti. La formula con la quale si rappresentano indica il rapporto minimo che si registra tra gli ioni. Il cloruro di sodio (NaCl) è formato da ioni sodio e cloro in rapporto 1:1, mentre il cloruro di magnesio (MgCl2) è costituito da ioni magnesio e cloro nel rapporto 1:2.
|
Legame covalente |
Questo tipo di legame si realizza quando si legano elementi dalle proprietà chimiche simili, i non-metalli, elementi caratterizzati dal possedere un alto numero di elettroni nel livello energetico esterno. In questa situazione nessuno dei due atomi è disposto a cedere i suoi elettroni, ma cerca di sottrarli all'altro atomo. Il legame si realizza perché i due atomi mettono in comune i propri elettroni fino a raggiungere l'ottetto; gli elettroni che vengono messi in comune prendono il nome di elettroni di legame.
L'acido cloridrico è un esempio di legame covalente.
L'idrogeno ha un elettrone nel livello energetico esterno e il cloro ne ha sette; mettendo in comune una coppia di elettroni (uno dell'idrogeno e uno del cloro) si realizza il legame covalente, che tiene uniti i due atomi.
Un legame di questo tipo è più forte del legame ionico visto in
precedenza. All'interno di questa categoria di legami la forza aumenta
all'aumentare del numero di coppie di legame esistenti tra i due elementi.
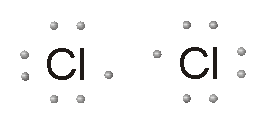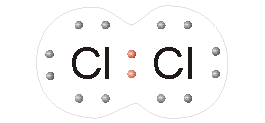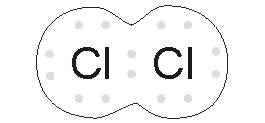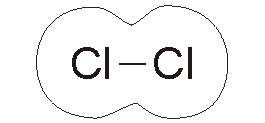 |
Qui a
fianco vediamo ciò che accade all'interno della molecola di cloro. Ogni
atomo condivide un elettrone con l'altro, creando una coppia di elettroni
condivisa che terrà uniti i due atomi finché qualche forza esterna non li
separerà. I composti covalenti hanno, di solito, forma ridotta e sono caratterizzati da una precisa formula che, in questo caso rappresenta gli atomi costituenti e il loro numero. L'ammoniaca NH3 è formata da un atomo di azoto e da tre atomi di idrogeno. |
|
Legame metallico |
Come fanno il sodio e gli altri metalli a
presentarsi in forma solida e a condurre elettricità?
Esiste un terzo tipo di legame tra atomi: quello metallico. Quando gli atomi di
un elemento metallico si trovano insieme non formano legami covalenti: il sodio,
per esempio, ha solo 1 elettrone nel livello più esterno e insieme ad un altro
atomo di sodio non potrebbe raggiungere l'ottetto né cedendo né condividendo
elettroni.
All'interno della struttura si trovano gli atomi sotto forma di ioni, mescolati ai propri elettroni (vengono chiamati "mare di elettroni"). Gli ioni positivi non si respingono tra loro proprio grazie alla presenza degli elettroni che restano liberi di muoversi: ecco spiegata la capacità di essere conduttori di elettricità tipica dei metalli.
|
Legami intermolecolari |
I tre tipi di legame che abbiamo studiato riguardano il caso
in cui siano atomi a legarsi tra loro. Esistono altri legami, di natura diversa,
che legano tra loro le molecole, formando strutture più complesse.
Il legame intermolecolare che ci interessa è il legame idrogeno, un legame molto
debole, ma fondamentale.
Questo legame si realizza a causa della polarità della
molecola dell'acqua; questa molecola non è uno ione (cioè non ha una carica
elettrica "piena") ma presenta forti frazioni di carica elettrica
localizzate all'estremità della molecola. Quando la temperatura è maggiore di 100°C
l'energia posseduta dalle molecole è più forte di questo legame e ogni
particella è indipendente dalle altre e l'acqua è allo
stato
gassoso.
Al calare della temperatura l'energia posseduta (che esprime la velocità con
cui si muovono le particelle) diminuisce e cominciano a formarsi dei legami
idrogeno e si ha la condensazione allo stato
liquido.
Quando la temperatura scende sotto lo 0°C tutte le molecole sono legate tra
loro l'acqua si trasforma in ghiaccio (acqua allo
stato
solido) che galleggia sul liquido su cui si è formato. L'aumento di volume è dovuto al fatto che la distanza tra le
molecole nello stato liquido è minore rispetto a quella dovuta alla presenza
massiccia di legami idrogeno.