CAMBIAMENTI DI STATO
 CAMBIAMENTI
DI STATO: IL RUOLO DELLA DENSITA' E DELLA PRESSIONE
CAMBIAMENTI
DI STATO: IL RUOLO DELLA DENSITA' E DELLA PRESSIONE
Adesso analizziamo più in dettaglio gli effetti che la densità e la pressionedi un gas hanno su alcune trasformazioni di fase, in particolar modo sulla condensazione, l'ebollizione e la sublimazione.
MOVIMENTI MOLECOLARI
Per comprendere appieno il fenomeno della condensazione, dell'ebollizione e della sublimazione bisogna descrivere brevemente cosa accade alle molecole.
Nel liquidi, nei gas ma anche nei solidi le molecole non sono
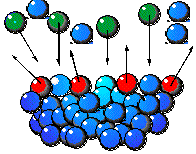 |
| Le molecole non sono mai immobili: alcune molecole di vapore si aggregano al liquido (verdi) mentre altre appartenenti al liqui-do evaporano via (rosse). |
mai immobili né sono chimicamente inerti; all'opposto, esse si muovono continuamente ed hanno reazioni chimiche con le molecole vicine. Ciò fa sì che in tempi brevissimi le molcole di un composto chimico si spezzino e si ricompongano con velocità vertiginosa. Noi non ci accorgiamo di questi fenomeni perché non siamo in grado di vedere cosa accade a dimensioni microscopiche. Se osserviamo un bicchiere d'acqua a temperatura non molto alta a mala pena possiamo accorgerci che alcune molecole, a causa dell'energia ricevuta da tutte le reazioni alle quali sono state sottoposte, si sono trasformate in gas ed evaporano via. La stessa cosa accade però anche nel gas che sta sopra l'acqua: le molecole di vapore, a causa degli urti, condensano di continuo formando piccolissime gocce.
Dunque, possiamo affermare che in un liquido le molecole si trasformano continuamente in gas e che in un gas le molecole condensano continuamente.
Forti di ciò che abbiamo appena scoperto, analizziamo più approfonditamente la condensazione, l'ebollizione e la sublimazione.



