|
ANIDRIDE CARBONICA A POCO PREZZO
|
|
|
Possibilità di un notevole risparmio, con acido citrico, bicarbonato di sodio ed una bottiglia vuota di champagne "fabbricheremo" anidride carbonica per le piante dell'acquario.
|
|
|
Il costo delle bombolette di CO2 (anidride carbonica) per uso acquariologico ultimamente è aumentato parecchio. La scarsa praticità delle bombolette piccole ha inoltre indotto i fabbricanti alla introduzione sul mercato di bombolette di maggiori dimensioni, con un metodo di erogazione uguale a quello degli spray di uso domestico, quindi molto più pratico. Il costo di queste bombolette però è elevatissimo rispetto al costo reale della CO2. Una bomboletta di una nota ditta contenente 11 g di CO2 viene venduta nella mia città a L. 16.000 circa, cioè a più di millequattocento lire al grammo! La CO2 è un gas, presente nell'atmosfera solo in quantità relativamente basse, dell'ordine dello 0,004%. La CO2 legata come anione di acido carbonico nei sali, è invece presente in relativa abbondanza in natura; basti pensare al marmo un carbonato di Calcio, oppure alla dolomite, un carbonato doppio di Calcio e Magnesio. e altri sali meno conosciuti e frequenti, per non parlare poi di sostanze biogeniche (gusci, scheletri, ecc.). Voglio esporre un metodo che consente la produzione di anidride carbonica ad un costo molto basso. Questa CO2 viene prodotta sfruttando una reazione chimica molto semplice, por cui non penso certo di essere la prima persona a cui sia venuta questa idea. La reazione avviene tra bicarbonato di sodio e acido citrico. Entrambe queste sostanze sono facilmente reperibili sfuse nei negozi di materiale chimico o enologico (vedere nelle pagine gialle), al costo di circa L.8000 al Kg per l'acido citrico, e a L.2000 al Kg per il bicarbonato. La qualità pura per analisi ha un costo molto superiore ma per l'uso a cui verrà destinata da noi è assolutamente sprecata. Queste sostanze si presentano come polveri bianche. Le loro formule chimiche sono;
Bicarbonato di sodio: NaHCO3 Acido citrico: C6H8O7
Le reazioni che avvengono sono due semplicissime: l'acido citrico, più forte dell'acido carbonico, sposta questo ultimo dal suo sale, salificandosi esso stesso. Si forma così dell'acido carbonico, che si dissocia nei suoi componenti, cioè acqua e anidride carbonica.
|
|
|
1) 3NaHCO3 + acido citrico -> citrato trisodico + 3H2CO3 (acido carbonico) 2) 3H2CO3 <-> 3H2O (acqua) + 3CO2 (anidride carbonica) |
|
|
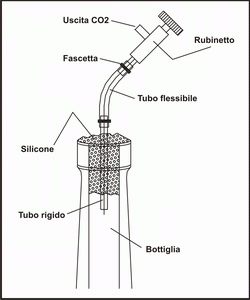
Con 192 g di acido citrico (L.1600) e 252 g di bicarbonato (L.500) si producono 130 g di anidride carbonica, che viene a costare circa L.16 al grammo! Questa reazione viene provocata in una bottiglia, che prima deve essere lavata ed asciugata perfettamente al suo interno. Si prende poi uno spezzone di tubicino di silicone per l'aria rigido (è indispensabile che sia di silicone) e si cementa con del mastice al silicone nel collo della bottiglia, sigillando il tutto accuratamente. Si preparano le sostanze chimiche nelle quantità sopra indicate o nelle stesse proporzioni, facendo passare il bicarbonato attraverso un colino di rete, meglio se di quelli con le maglie di nailon, per rompere i grumi presenti. Si uniscono fra di loro e si mescola bene, usando sempre attrezzi ben asciutti, in quanto l'acqua innesca la reazione e si avrebbe una perdita di anidride carbonica. Con pazienza, aiutandoci con un piccolo imbuto di carta, si introduce il miscuglio attraverso il tubicino silgillato nel collo della bottiglia. Se invece si introducono le polveri prima di sigillare la bocca della bottiglia col silicone, il bicarbonato reagisce con l'acido acetico che si sviluppa dal mastice durante la sua polimerizzazione e si avrebbe una predita di CO2.
|
|
|
|
Sul tubo si inserisce un rubinetto per l'aria e lo si assicura con delle fascette stringitubo ( vedi figura). Sono molto comode quelle piccole in nailon autobloccanti (nei negozi di materiale elettrico o elettronico). Si innesca la reazione introducendo dal tubicino tramite il rubinetto, con l'aiuto di una siringa e di un tubo di silicone morbido, un poco di acqua chiudendo subito il rubinetto. Poi si toglie la siringa. La reazione inizia immediatamente e si vedrà la polvere nella bottiglie che comincia a schiumeggiare. È consigliabile fasciare completamente la bottiglia con qualche giro di nastro adesivo, di quello che si usa per i pacchi, per evitare lo sparpagliamento di frammenti di vetro nel caso che la bottiglia non resistesse alla pressione che si crea al suo interno. |
|
Per sicurezza si può tenere la bottiglia per alcune ore sul terrazzo o in cortile, per verificarne la tenuta alla pressione. Io ho però usato bottiglie di spumante a fermentazione in bottiglia (metodo Champenoise), e finora non se ne è mai rotta nessuna. L'importante è aggiungere pochissima acqua all'inizio, circa 5ml massimo. Con il procedere della reazione, la CO2 che si produce causa un aumento della pressione all'interno della bottiglia, fino a quando questo ostacola la reazione stessa, per cui si ha una autolimitazione e la pressione si stabilizza. Quando preleviamo CO2 dal rubinetto, la pressione all'interno scende leggermente, e le reazioni ripartono fino al ripristino delle condizioni di prima. Se si rispettano i valori dei pesi dei reagenti o del loro rapporto prima indicati, essi reagiscono completamente e alla fine non si ha un componente in eccesso. Esempio di chiusura con silicone di una bottiglia per la riproduzione di C02. Prima comunque di buttare una miscela che apparentemente non produce più anidride carbonica si può provare ad aggiungere un altro po' di acqua. È necessario ad intervalli di tre o quattro giorni rinnovare completamente il gas contenuto nel tubo di diffusione. Infatti i gas disciolti nell'acqua tendono a passare nel tubo attraverso la membrana, e ciò dà l'errata convinzione che il tubo del diffusore sia pieno di CO2 che non viene utilizzata, mentre invece si tratta di ossigeno e di azoto e la CO2 è già sparita. Questo accorgimento vale in ogni caso, anche se si utilizzano le bombolette commerciali. Come reagenti si possano usare anche le polveri per la preparazione dell'acqua frizzante vendute nei supermercati. La reazione è la stessa. I sali, contenuti nelle bustine già nelle giuste proporzioni, sono bicarbonato di sodio e acido tartarico. Una scatola di bustine contiene circa 100 g di polvere, costa circa 2000 lire e produce circa 30 g di CO2, ad un prezzo di circa 70 lire al grammo. Anche in questo modo si mantiene quindi una notevole convenienza rispetto all'acquisto delle bombolette. Siamo così riusciti ad ottenere dell'anidride carbonica ad un prezzo molto basso. I soldi risparmiati potranno venire investiti per esempio in piante acquatiche, che cresceranno rigogliose in quanto potremo saziare la loro fame di CO2 senza che ciò implichi una pericolosa 'tendenza al rosso' delle nostre finanze.
|
|
|
|
|