Sali poco solubili
![]()
Cosa sono i Sali
poco solubili
Prima di andare a vedere cosa si intende
per Sali poco solubili, cerchiamo di dare una definizione di solubilità.
Per solubilità di una sostanza si definisce la massima quantità
di un determinato soluto che può essere disciolto in un certo volume di
solvente e viene misurata in g/L o moli/L. Dove, per massima quantità si
intende la quantità oltre la quale il soluto non riesce più a
passare in soluzione e si deposita in forma solida sul fondo del Beker
all’interno del quale si sta preparando la soluzione.
I Sali poco solubili, sono particolari
Sali, per i quali la solubilità è molto, molto bassa, ciò
significa, che i Sali poco solubili, sono Sali che passano
“malvolentieri” in soluzione. Alcuni esempi sono dati dal cloruro
d’argento (AgCl), dall’idrossido di calcio (Ca(OH)2), etc…
Costante di
solubilizzazione (kps)
Quando un sale raggiunge il suo punto di
massima solubilizzazione in un determinato solvente e inizia a depositarsi in
forma solida sul fondo del beker, possiamo dire che si istaura una sorta di
equilibrio fra il sale in forma solida e il sale in forma ionica presente in
soluzione. Quindi, preso il generico sale AX, possiamo scrivere:
AX + H2O «
A+ + X-
Trattandosi di un equilibrio fra due
differenti fasi, possiamo calcolarne la costante di equilibrio, che in questo
caso sarà data da:
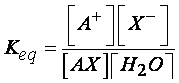
Se si considera che la concentrazione
dell’acqua e quella del sale allo stato solido, possono essere ritenute
costanti, allora abbiamo che il valore della costante di equilibrio dipende
solo ed esclusivamente dalle concentrazioni degli ioni presenti in soluzione:
![]()
La costante sopra riportata prende il nome
di costante
di solubilizzazione (Kps) di un sale in condizioni standard
(T=298,15K). Il valore che viene espresso dalla costante di solubilizzazione,
ci permette di suddividere i Sali in poco solubili (possiedono una costante
di solubilizzazione molto piccola <<1) e molto solubili
(possiedono una costante di solubilizzazione molto elevata >>1).
Facciamo alcuni esempi:
Esempio 1: scrivere la costante di
solubilizzazione per l’idrossido d’alluminio (Al(OH)3)
La reazione di dissociazione ionica
dell’idrossido di alluminio è la seguente:
Al(OH)3 + H2O «
Al3+ + 3OH-
La costante di solubilizzazione sarà
data da:
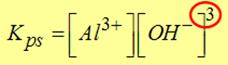
ATTENZIONE!!!! Per chi non dovesse ricordarlo, quando si scrive una
costante di equilibrio, di qualsiasi natura essa sia, si deve sempre tenere
conto dei coefficienti stechiometrici!!!!!
Esempio 2: calcolare la costante di
equilibrio dell’idrossido ferrico, sapendo che la concentrazione
all’equilibrio dello ione Fe3+ e pari a 1,5×10-4moli/L e quella dello ione
OH- e pari a 4,5×10-4moli/L
La reazione di dissociazione ionica
dell’idrossido ferrico è la seguente:
Fe(OH)3 + H2O « Fe3+ + 3OH-
La costante di solubilizzazione sarà
data da:
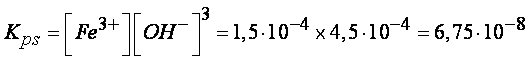
Calcolo della solubilità
di un sale sapendo la costante di solubilizzazione
Riveste particolare importanza il calcolo
per determinare, sapendo la costante di solubilizzazione di un determinato
sale, la solubilità di un certo sale. Per poter determinare la
solubilità di un determinato sale, conoscendone la costante di
solubilizzazione, si deve procedere nel seguente modo:
- Per
prima cosa, è necessario scrivere la reazione di dissociazione del
sale preso in considerazione e la relativa costante di solubilità:
AX + H2O «
A+ + X-
![]()
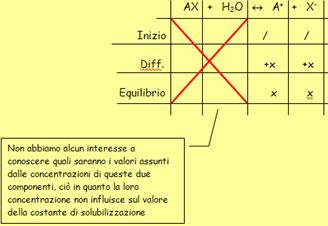
- Una
volta fatto ciò, si deve costruire una tabella all’interno
della quale, si vanno a riportare quelli che sono i valori assunti dalle
concentrazioni delle diverse componenti presenti all’interno del reattore
(in questo caso all’interno del beker in cui si sta preparando la
soluzione) all’inizio del processo e all’equilibrio:
- Una
volta costruita la tabella riportata sopra, non rimane altro che
sostituire i valori riportati nell’ultima riga all’interno
della formula per il calcolo della costante di solubilizzazione e
risolvere l’equazione che ne viene fuori:

Facciamo alcuni esempi:
Esempio 3: calcolare la solubilità
del floruro di calcio (CaF2), sapendo che la sua costante di
solubilità è: 1,15×10-10
La reazione di dissociazione ionica del
floruro di calcio è la seguente:
CaF2 + H2O «
Ca2+ + 2F-
E la relativa costante di solubilità
sarà data da:
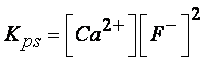
Lasciando a voi la costruzione della
tabella, la concentrazione all’equilibrio degli ioni Ca2+ e
degli ioni F- saranno dati dalla risoluzione della seguente
equazione:
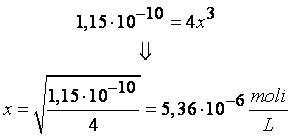
Ciò significa che la concentrazione
degli ioni Ca2+ è pari a 5,36×10-6M mentre la concentrazione
all’equilibrio degli ioni F- sarà paria a 1,072×10-5M. Invece la
solubilità del floruro di calcio sarà pari a 5,36×10-6moli/L, pari alla
concentrazione dello ione Ca2+.
Effetto dello
ione comune
Cercheremo ora di andare ad analizzare
quali sono gli interventi esterni che possono far variare il valore della
costante di solubilizzazione di un sale. In pratica, andremo a vedere quali
sono i fattori che possono spostare a destra o sinistra l’equilibrio di
dissociazione ionica di un sale poco solubile. Uno di questi è
sicuramente la temperatura, infatti, è facile verificare che con
l’aumentare della temperatura la solubilità di un sale aumenta.
Ciò è spiegabile, se si considera che per consentire il passaggio
in soluzione di una determinata molecola di sale, si devono spaccare dei
legami, i quali, per essere spaccati richiedono una piccola quantità di
energia, che se la temperatura è più elevata, è più
facile da reperire.
Un secondo fattore che può influire
sull’equilibrio di solubilizzazione di un sale poco solubile, è
dato dal cosiddetto effetto dello ione comune. Esso è dovuto,
fondamentalmente all’introduzione all’interno della soluzione
satura di un sale poco solubile, di una seconda sostanza che libera, una volta
posta in soluzione, una enorme quantità di uno degli ioni che vengono
liberati dal sale poco solubile. Per fare un esempio, si prenda una soluzione
satura di cloruro d’argento (AgCl) e si aggiunga a questa una punta di
spatola di cloruro di sodio (NaCl) sale molto solubile; immediatamente si
osserverà la precipitazione di una sostanza dal colore bianco
lattiginoso (AgCl(S)). Tale osservazione empirica è
spiegabile se si considera che l’introduzione, all’interno della
soluzione, del cloruro di sodio ha provocato la liberazione di una enorme
quantità di ione Cl- che sono andati, in accordo con il
principio di Le Chatelier a spostare verso sinistra l’equilibrio di
solubilizzazione del cloruro d’argento, provocandone la precipitazione:
AgCl(S) + H2O « Ag+ + Cl-
+
NaCl + H2O ® Na+ + Cl-
ß
AgCl(S) + H2O ¬ Ag+ + Cl-
L’effetto dello ione comune viene
sfruttato a livello industriale per la depurazione delle acque. Infatti, presa
una certa quantità di acqua contenente metalli pesanti, è
sufficiente aggiungere a tale soluzione determinati ioni per provocare la
precipitazione, sotto forma di Sali allo stato solido dei metalli pesanti, i
quali verranno poi allontananti mediante filtrazione ed avviati allo smaltimento
secondo le normative vigenti.