elettrolisi
Elettrolisi:processo chimico che assorbendo energia elettrica
produce una trasformazione chimica mediante reazione redox o di
ossidoriduzione
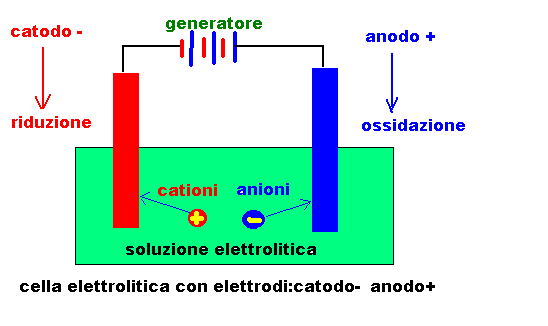
Dispositivo ed elementi partecipanti alla elettrolisi
cella elettrolitica(recipiente contenente un elettrolita fuso
o una soluzione elettrolitica:sale,acido,base in acqua)
elettrodi(inerti-platino,carbone,o reattivi)collegati a un
generatore di corrente continua(batteria):
elettrodo collegato al polo negativo:CATODO
elettrodo collegato al polo positivo:ANODO
particelle allo stato di ioni(derivate dall'elettrolita)
mediante dissociazione(se già esistenti nell'elettrolita)
mediante ionizzazione(se non preesistenti nell'elettrolita)
es. (Na+Cl-) ----> elettrolita di tipo ionico
dissociazione in Na+ Cl-
es. (HCl) ----> elettrolita di tipo covalente polare
ionizzazione in H+ Cl-
reazioni agli elettrodi ove migrano gli ioni:
CATODO :migrano i cationi o ioni positivi:avviene una riduzione
ANODO :migrano anioni o ioni negativi :avviene una ossidazione
CATODO :catione+ elettroni --->atomo neutro...Na+ + e -->Na°
ANODO :anione - elettroni --->atomo neutro...Cl- - e -->Cl°
nell'insieme si ha una reazione di ossidoriduzione o redox
NOTA:nel caso siano contemporaneamente presenti più sostanze
che possono ridursi o ossidarsi,si applica una regola generale
che prende in considerazione i potenziali di riduzione standard,
le concentrazioni degli ioni e altri parametri(sovratensione..)

spiegazione del fenomeno elettrolitico: un elettrolita(acido,sale,base) viene introdotto in un recipiente e si trasforma in particelle cariche:ioni: positive o cationi(ioni che migrano al polo negativo o catodo) negative o anioni (ioni che migrano al polo positivo o anodo ) la trasformazione avviene fornendo energia termica(elettrolisi ignea) oppure solubilizzando gli elettroliti in acqua i cationi richiamati verso il catodo,ricco di elettroni,vengono neutralizzati(riduzione) gli anioni richiamati verso l'anodo,ricco di cariche positive,vengono neutralizzati(ossidazione) la reazione globale risulta una ossidoriduzione:fasi successive: 1-dissociazione o ionizzazione dell'elettrolita 2-migrazione degli ioni agli elettrodi di segno opposto 3-reazioni di riduzione e ossidazione (talvolta anche il solvente,acqua,può concorrere nelle reazioni agli elettrodi,come pure gli elettrodi se non sono inerti)esempio:2NaCl + calore ----> 2Na+ + 2Cl- ---> ??? catodo(riduzione) 2Na+ + 2e ---> 2Na° anodo (ossidazione) 2Cl- - 2e ---> Cl2° (redox) 2Na+ + 2Cl- ---> 2Na° + Cl2° per altri esempi vedi pagina seguente elettrolisi ignea elettrolisi in soluzione acida elettrolisi in soluzione basica elettrolisi in soluzione salina elettrolisi con elettrodi reattivi(galvanoplastica,galvanostegia)