Torna a ARGOMENTI DI CHIMICA FISICA
DIAGRAMMA DI STATO DI DUE COMPNENTI
GASSOSI PARZIALMENTE MISCIBILI ALLO STATO LIQUIDO
Consideriamo
una miscela di due componenti gassosi, 1
e 2 che si trova ad una
temperatura sufficientemente elevata Ta (punto A della figura
sottostante). Ciascun componente possiede una frazione molare, e la somma delle
due frazioni molari è ovviamente1. Supponiamo che la frazione molare del
componente 1 sia più grande di
quella del componente 2 (punto A della figura, in corrispondenza del quale la
frazione molare del componente
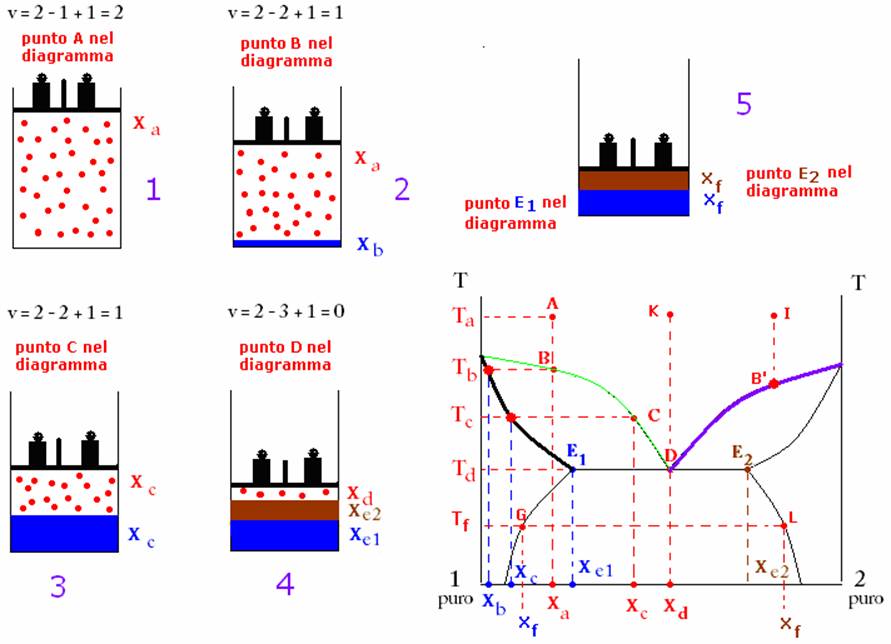
Non
si presenta alcun cambiamento nel numero di fasi e di composizione della
miscela fin quando la temperatura non si abbassa al valore Tb, in corrispondenza del quale, nel punto B, si tocca la curva verde i cui punti rappresentano
stati di equilibrio fra la miscela gassosa e la fase liquida, costituita da una
soluzione del componente 2, soluto,
nel componente 1, solvente. La curva verde definisce, ad ogni temperatura, la composizione della
miscela gassosa in equilibrio con la fase liquida (soluzione). Nel
punto B perciò compare una piccola quantità di
fase liquida, la cui composizione viene ricavata mandando la parallela all’asse
delle ascisse dal punto B fino ad incontrare la
curva nera, che definisce ad ogni
temperatura la composizione della fase liquida (soluzione) in equilibrio col
gas (miscela gassosa). Dal punto di incontro si manda quindi la
perpendicolare all’asse delle ascisse. L’incontro di questa con l’asse delle
ascisse dà il valore della frazione molare del componente 1 (solvente), Xb nella figura ( e quindi, da
1 – Xb, si ricava la frazione molare
del componente 2 , soluto, nella
soluzione). La composizione della miscela gassosa nel punto B è ancora uguale al valore iniziale nel punto A (Xa. Il
sistema nel punto B diventa perciò monovariante
per la comparsa della fase liquida (infatti v = 2 componenti – 2 fasi + 1[solo la variabile
temperatura] = 1).
Nello
stato 2 è rappresentata fisicamente la situazione che si presenta in
corrispondenza del punto B: nel cilindro la miscela gassosa di
composizione Xa è in compresenza della soluzione liquida
(indicata da un sottile strato liquido di colore blu) di composizione Xb (vi ricordo che Xa e Xb sono le frazioni molari nel gas e nel liquido del
componente 1. Le
corrispondenti frazioni molari del componente
2 si ricavano per complemento
ad 1).
Continuando
il raffreddamento del sistema, la composizione della fase gassosa varia secondo
la curva verde,
mentre la corrispondente composizione della soluzione in equilibrio con il gas
varia secondo la curva nera. Ad
esempio, raffreddando il sistema fino alla temperatura TC,
la composizione della miscela gassosa è Xc,
relativa al punto C della curva verde,
mentre la composizione della soluzione in equilibrio con la miscela gassosa è Xc.
Per ulteriore raffreddamento, al valore Td della temperatura la composizione della miscela gassosa
assume il valore Xd e, corrispondentemente, compaiono due
soluzioni immiscibili tra loro aventi composizione rispettivamente Xe1 e Xe2 corrispondenti ai punti E1 ed E2 del
grafico. La soluzione di composizione Xe1 ha come sovente il componente 1 e come soluto il componente 2, mentre la soluzione di composizione Xe2
ha come solvente il componente 2,
mentre ha come soluto il componente 1.
L’una è immiscibilei nell’altra, perciò alla temperatura Td il sistema diventa trifasico (miscela gassosa, soluzione E1, soluzione E2)
(vedi stato 4). La varianza del sistema in queste condizioni è
perciò: v = 2
componenti – 3 fasi + 1[solo la variabile temperatura] = 0).
Raffreddando ulteriormente il sistema al di sotto della
temperatura Td, ad esempio alla temperatura Tf, il sistema ridiventa monovariante, essendo scomparsa la
fase gassosa e rimanendo due fasi (le due soluzioni immiscibili), le cui
composizioni sono ricavate rispettivamente dai due punti G e L di intersezione della parallela all’asse
delle ascisse condotta alla temperatura Td, con
le curve di equilibrio fra le due soluzioni. Da tali punti, inviando la
perpendicolare all’asse delle ascisse, si ricavano le composizioni delle due
soluzioni (che, come si vede sono funzioni della temperatura del sistema,
poiché variano al variare di questa). Esse sono rispettivamente Xf e Xf.
Se partissimo da una miscela gassosa di composizione Xd, corrispondente al punto D del diagramma
di stato, per raffreddamento si otterrebbe alla temperatura Td direttamente un sistema trifasico a varianza 0, con la
miscela gassosa a composizione Xd e le due soluzioni immiscibili a
composizione rispettivamente Xe1 e Xe2.
Per ulteriore raffreddamento, come già visto, le soluzioni immiscibili varierebbero
le loro composizioni rispettivamente secondo le curve nere di destra e di
sinistra in basso nel diagramma.
Infine, se la miscela gassosa presenta una composizione più ricca
nel componente 2,
vedi ad esempio il punto I della figura, per raffreddamento il
sistema, arrivato al punto B’ seguirà le curve viola e nera
che indicano rispettivamente la composizione della miscela gassosa e della
soluzione di 1, soluto, in 2, solvente alle varie temperature. Al diminuire della temperatura,
il sistema si comporta in modo analogo a quello visto in precedenza ( miscela
di composizione Xa al punto A). Se la
temperatura diminuisce fino al punto D, si formano
sempre due soluzioni E1 e E2, di
composizione Xe1 e Xe2,
in equilibrio con la miscela gassosa di composizione Xd, relativa al punto D (varianza 0). Un
ulteriore diminuzione di temperatura, ad es. al valore Tf, originerebbe le stesse soluzioni già descritte nel caso
della miscela gassosa più ricca nel componente 1.
Torna a ARGOMENTI DI CHIMICA FISICA