Effetti strutturali e di solvente nelle reazioni di
sostituzione nucleofila degli alogenuri alchilici
Torna a
ARGOMENTI DI CHIMICA
ORGANICA
|
Reazioni
SN2 |
Reazioni SN1 |
|
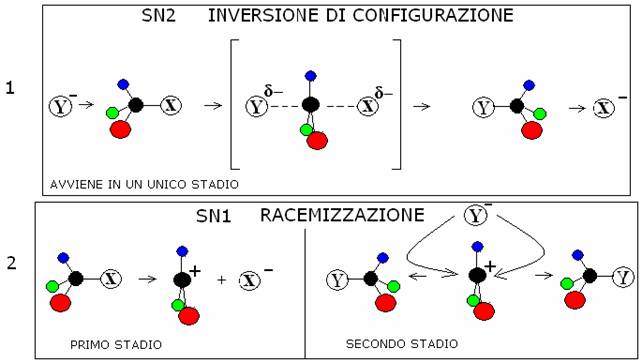
Stereochimica delle reazioni SN2 INVERSIONE DELLA CONFIGURAZIONE (INVERSIONE DI WALDEN) Avvengono in un unico stadio VEDI FIGURA 1 |
a)
Stereochimica
delle reazioni SN1 RACEMIZZAZIONE Avvengono in due stadi, nel
primo dei quali si forma un carbocatione VEDI FIGURA 2 |
|
a)
Struttura dei
gruppi alchilici legati all’alogeno La velocità della sostituzione SN2 segue l’ordine: R primario > R secondario > R terziario (per un dato alogeno)
Le reazioni SN2 sono infatti fortemente influenzate dagli effetti sterici: più ingombrante è il gruppo alchilico, meno facile è l’attacco del nucleofilo. |
b)
Struttura dei
gruppi alchilici legati all’alogeno La velocità della sostituzione SN1 segue l’ordine: R terziario > R secondario > R primario (per un dato alogeno)
Le reazioni SN1 sono infatti
fortemente influenzate dagli effetti
elettronici: più stabile è il carbocatione,
più facilmente esso si forma, e quindi più probabile l’attacco del nucleofilo. |
|
c)
Partecipazione del
gruppo vicinale: assistenza
anchimerica Alcuni
gruppi legati al carbonio che subisce la sostituzione possono interagire con
esso, portando alla ritenzione della configurazione |
|
|
d)
Gruppo uscente La reattività degli alogenuri alchilici, sia nelle reazioni SN1, sia nelle reazioni SN2, è determinata in parte dalla natura del gruppo uscente. In generale vi è una buona correlazione tra la forza dell’acido H−X e la reattività di R−X, nel senso che maggiore è la forza dell’acido alogenidrico HX, più facilmente l’alogeno X- viene sostituito, e quindi più reattivo è l’alogenuro alchilico RX. Poiché la forza degli acidi alogenidrici segue l’ordine: HI>HBr>HCl>HF, l’ordine di reattività degli alogenuri alchilici, a parità del gruppo R, è perciò: R−I> R−Br> R−Cl> R−F |
d)
Gruppo uscente La reattività degli alogenuri alchilici, sia nelle reazioni SN1, sia nelle reazioni SN2, è determinata in parte dalla natura del gruppo uscente. In generale vi è una buona correlazione tra la forza dell’acido H−X e la reattività di R−X, nel senso che maggiore è la forza dell’acido alogenidrici HX, più facilmente l’alogeno X- viene sostituito, e quindi più reattivo è l’alogenuro alchilico RX. Poiché la forza degli acidi alogenidrici segue l’ordine: HI>HBr>HCl>HF, l’ordine di reattività degli alogenuri alchilici, , a parità del gruppo R, è perciò: R−I> R−Br> R−Cl> R−F |
|
e)
Reagenti
nucleofili La nucleofilicità
di un reagente è definita come la sua capacità di donare un doppietto
elettronico al carbonio. In linea di massima la nucleofilicità è
correlata alla sua basicità, cioè alla sua capacità di donare un
doppietto elettronico ad un protone. Ma questo parallelismo non è sempre
osservato. Ad esempio, la nucleofilicità degli ioni alogenuro segue l’ordine
I-> Br-> Cl-> F-,
opposto all’ordine di basicità F->
Cl- > Br - > I -. Sembra
che alla base di questo fenomeno vi siano le differenze delle energie di
solvatazione degli ioni. Esse
dipendono dalla loro carica e dalle loro dimensioni. A parità di carica, ioni
piccoli sono più solvatati dalle molecole di solvente (circondati da un
numero più grande di molecole di acqua). Ciò rende più difficoltoso l’attacco
di tali ioni al carbonio nella reazione SN1 o SN2. |
e)
Reagenti
nucleofili La nucleofilicità
di un reagente è definita come la sua capacità di donare un doppietto
elettronico al carbonio. In linea di massima la nucleofilicità è
correlata alla sua basicità, cioè alla sua capacità di donare un
doppietto elettronico ad un protone. Ma questo parallelismo non è sempre
osservato. Ad esempio, la nucleofilicità degli ioni alogenuro segue l’ordine
I-> Br-> Cl-> F-,
opposto all’ordine di basicità F->
Cl- > Br - > I -. Sembra
che alla base di questo fenomeno vi siano le differenze delle energie di
solvatazione degli ioni. Esse
dipendono dalla loro carica e dalle loro dimensioni. A parità di carica, ioni
piccoli sono più solvatati dalle molecole di solvente (circondati da un
numero più grande di molecole di acqua). Ciò rende più difficoltoso l’attacco
di tali ioni al carbonio nella reazione SN1 o SN2. |
|
f)
La natura del
solvente La
natura del solvente può influenzare in diversa misura la velocità delle
reazioni SN2, a seconda della tipologia delle molecole reagenti: 1)
RX + Y → RY+
+ X- 2)
R+X + Y-
→ RY + X 3)
RX + Y-
→ RY + X- Nel
caso delle reazioni 1) e 2), nei rispettivi stati di transizione si verifica un grande cambiamento nel grado
di separazione della carica elettrica:
[Y---Rδ+---X δ-] e [Y
δ----Rδ+---X]. In questi casi la capacità del solvente di
solvatare le particelle cariche è una caratteristica importante. E’ invece
meno importante nel caso delle reazione del tipo 3), nelle quali non si
sviluppa una carica elettrica notevole, essendo essa dispersa tra X e Y: [Y
---R---X]-. |
f)
La natura del
solvente La velocità delle reazioni SN1 dipende fortemente dalla natura del solvente, poiché esso può favorire la formazione degli ioni R+---X-
da RX. Solventi con elevato valore della costante dielettrica rendono più
facile la formazione di ioni. Un fattore correlato alla costante dielettrica,
probabilmente più importante, è la capacità del solvente di solvatare gli
ioni. |
Effetti strutturali e di
solvente nelle reazioni di eliminazione degli alogenuri alchilici
|
Reazioni di eliminazione E2 |
Reazioni di eliminazione E1 |
|
a) stereochimica delle reazioni E2 Avvengono in un solo stadio e
portano alla formazione di un alchene. I gruppi uscenti (l’alogeno e
l’idrogeno) sono disposti preferibilmente nella conformazione s-trans. Con
gli alogenuri che hanno gruppi R non simmetrici, si forma in preponderanza
l’alchene più sostituito (ad eccezione dei casi in cui quello più sostituito
presenta un forte impedimento sterico). Sono sempre in competizione con le
reazioni SN2. (VEDI FIGURA 1) |
a) stereochimica delle reazioni E1 Avvengono in due stadi, nel
primo dei quali si forma un carbocatione, e portano alla formazione di un
alchene. Con gli alogenuri che hanno gruppi R non simmetrici, si forma in
preponderanza l’alchene più sostituito, (ad eccezione dei casi in cui quello
più sostituito presenta un forte impedimento sterico). Sono sempre in
competizione con le reazioni SN1. |
|
b) struttura dei gruppi alchilici La velocità della eliminazione E2 segue l’ordine: R primario > R secondario > R terziario (per un dato
alogeno). A differenza delle reazioni SN2, le reazioni E2 sono comunque poco
influenzate dalla struttura del gruppo alchilico legato all’alogeno. |
b)
struttura dei
gruppi alchilici La
velocità si eliminazione E1 segue l’ordine: R
terziario > R secondario > R primario ( per un dato alogeno) |
|
c) influenza dell’alogeno uscente A parità della struttura dei
gruppi legati all’alogeno, la velocità di eliminazione
dell’alogeno segue l’ordine I > Br > Cl > F |
c)
influenza
dell’alogeno uscente A parità della struttura dei
gruppi legati all’alogeno, la velocità di eliminazione
dell’alogeno segue l’ordine I > Br > Cl > F |
|
d)
influenza del
nucleofilo le
reazioni di eliminazione E2 dipendono notevolmente dalla forza del
nucleofilo. Sono indicate basi forti e poco polarizzabili, nell’ordine -NH2 >-OC2H5>-OH>-OCCH3 (l’impedimento
sterico di una base, come -OCCH3, può
favorire la formazione dell’alchene meno sostituito) |
d) influenza del nucleofilo Le reazioni E1 sono avvengono in
prevalenza in presenza di basi deboli o di moderata forza. |
|
e)
effetto del
solvente e della temperatura L’eliminazione
viene facilitata rispetto alla sostituzione dall’impiego di solventi poco
polari e da temperature elevate |
f)
effetto del
solvente e della temperatura L’eliminazione
viene favorita da solventi polari di natura basica o anfiprotica (H2O),
che solvatano e stabilizzano il carbocatione, e da elevate temperature. |
Torna a ARGOMENTI DI CHIMICA ORGANICA
