Torna a ARGOMENTI DI CHIMICA ORGANICA
COMPOSTI
ETEROCICLICI AROMATICI
Alcuni importanti
eterociclici:

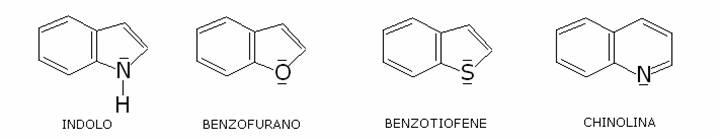
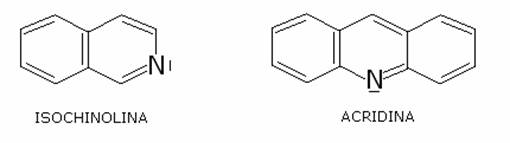
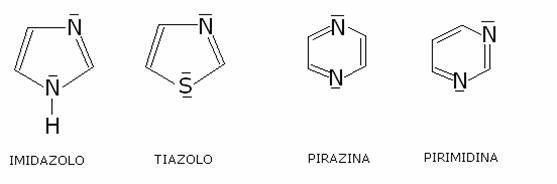
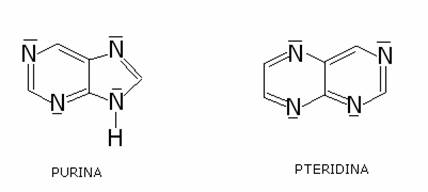
Le
regole di nomenclatura per i composti eterociclici sono sintetizzate nella
seguente tabella:
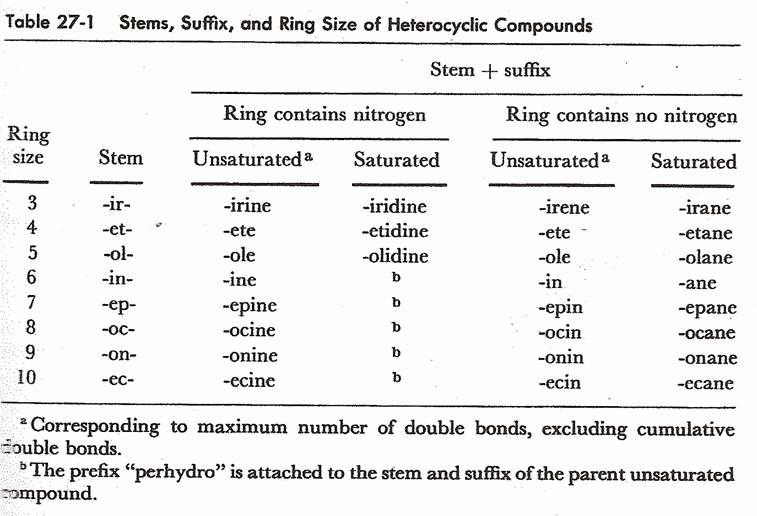
La
numerazione delle posizioni degli anelli eterociclici parte dall’eteroatomo e
procede verso destra o sinistra nell’anello in modo da attribuire il numero più
basso al o ai sostituenti (o ad altri eteroatomi). Se nell’anello vi sono due
eteroatomi diversi, l’ossigeno precede lo zolfo e lo zolfo precede l’azoto per
la posizione n° 1. Esempi:

Gli
anelli parzialmente ridotti (saturati) possono essere defiiniti come diidro o
tetraidro derivati dei corrispondenti composti insaturi. La saturazione può
essere indicata premettendo il simbolo H, insieme ad un numero indicante la
posizione della saturazione, al nome dell’analogo composto insaturo:

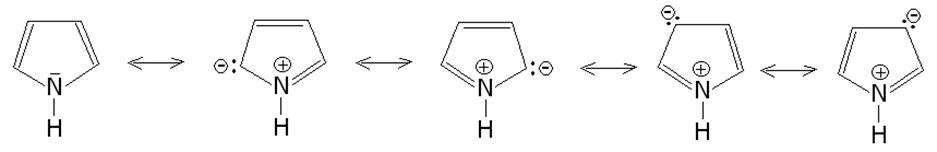
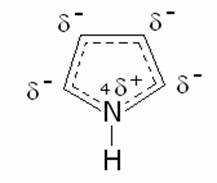
I
composti eterociclici pentatomici, pirrolo, furano, tiofene possiedono un
considerevole carattere aromatico derivante dalla deolocalizzazione di quattro
elettroni p dei quattro atomi di carbonio e del doppietto
elettronico donato dall’eteroatomo. Questa combinazione forma un sestetto
aromatico di elettroni delocalizzati. La struttura di ciascun eterociclico può
perciò essere descritta come ibrido di risonanza di diverse forme limiti.
Nell’esempio seguente è riportato il pirrolo:
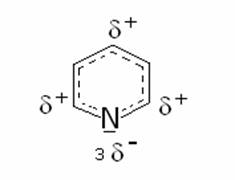
Tra
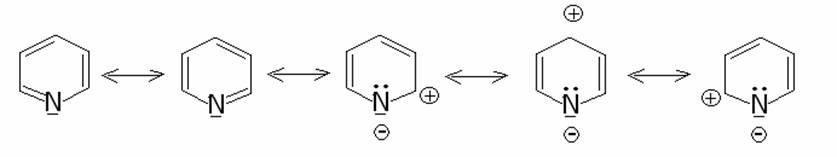
i composti eterociclici esatomici la piridina ha una struttura fortemente
assomigliante a quella del benzene, con una pronunciata energia di stabilizzazione
aromatica che è il risultato della delocalizzazione di 6 elettroni p , uno da ciascuno dei cinque atomi di carbonio e uno dell’atomo di
azoto
PROPRIETA’ CHIMICHE DEL PIRROLO, FURANO TIOFENE E
PIRIDINA
1) Proprietà
basiche.
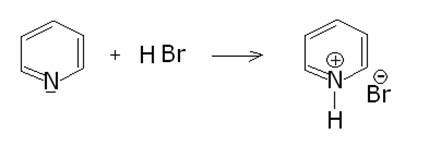
La
piridina è una base debole che forma sali di piridinio con acidi forti:
La forza basica del furano e del pirrolo non
può essere stimata poiché essi polimerizzano in soluzioni acide, sebbene sia possibile
prevedere, dalle formule limiti di risonanza, che la cessione del doppietto
elettronico ad un protone, da parte dell’azoto o dell’ossigeno, distruggerebbe
il sistema aromatico dei due composti. Il tiofene non presenta alcuna proprietà
basica.
2) Carattere
acido.
Il furano e il tiofene,non presentando
atomi di idrogeno direttamente legati agli eteroatomi ossigeno e zolfo,
ovviamente non possiedono alcun carattere acido. Il pirrolo invece è debolmente
acido e forma sali di metalli alcalini. Forma sali anche con i reattivi di
Grignard:

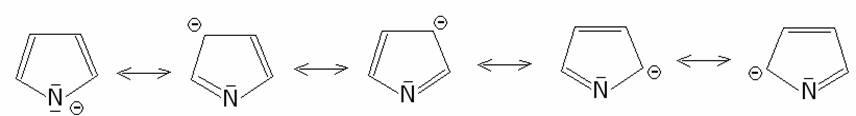
L’acidità del pirrolo, stimata intorno a 10-15
è più elevata di quella delle ammine alifatiche di un fattore di circa 1018.
Ciò è dovuto in primo luogo dalla stabilità del sistema aromatico dell’anione
pirrolico che si forma dopo il distacco dell’idrogeno dall’azoto, il cui ibrido
di risonanza è il contributo delle seguenti formule limiti di risonanza:
Una seconda causa deriva dal maggior carattere s del
legame N-H nel pirrolo (in cui l’azoto presenta ibridazione sp2)
rispetto a quello delle ammine (in cui l’azoto presenta ibridazione sp3).
3) Reazioni di
sostituzione elettrofila aromatica.
Il pirrolo, il furano e il tiofene sono estremamente
reattivi rispetto alle reazioni di sostituzione elettrofila. In questi anelli
la posizione preferenzialmente attaccata è la 2. Il motivo è chiaro se si
confrontano le formule limiti di risonanza relativi agli attacchi nella
posizione 2 e nella posizione 3:
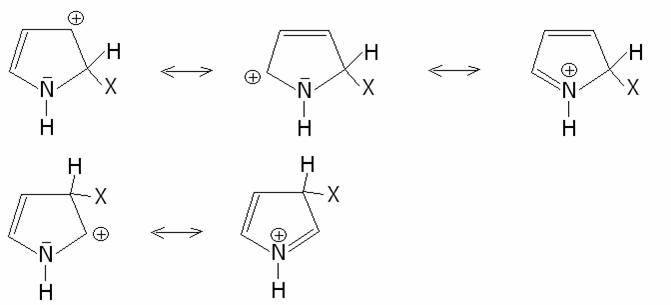
Come si vede infatti, nella posizione 3 sono possibili
solo due formule di risonanza rispetto alle tre che si possono scrivere per
l’attacco nella posizione 2.
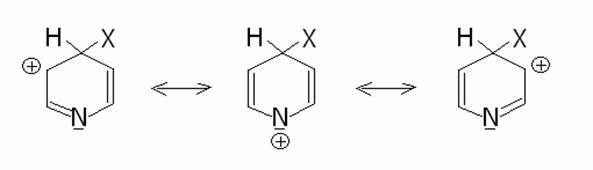
La piridina è molto meno reattiva
rispetto al benzene riguardo alla reazione di sostituzione elettrofila. In
questo caso la posizione 3 è quella in cui si verifica preferenzialmente
l’attacco dell’elettrofilo, poichè nelle posizioni 2 o 4 una delle formule
limiti presenta una carica positiva centrata sull’azoto, più elettronegativo
del carbonio, e quindi più instabile.

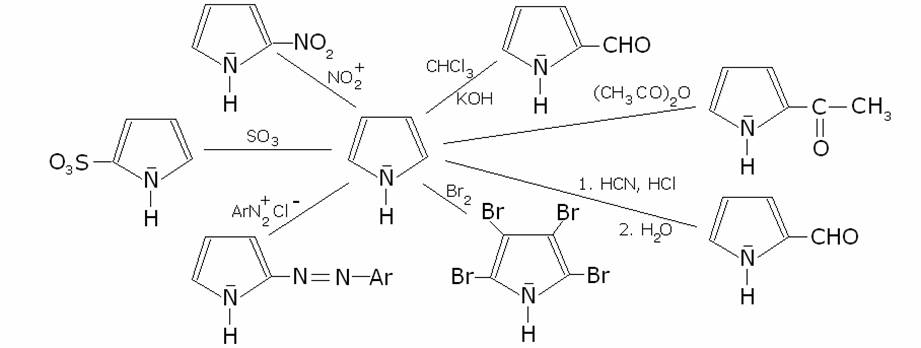
Le
principali reazioni di sostituzione elettrofila a cui sono soggetti il pirrolo,
il furano e il tiofene sono la nitrazione,
la solfonazione, la diazocopulazione (non per il tiofene),
la formilazione di Reimer-Tiemann (non per il tiofene e il furano), la formilazione di Gattermann (non per il tiofene), l’acilazione di Friedel-Kraft, la bromurazione. Schematizziamo queste reazioni per il pirrolo:
Come abbiamo già detto, la reattività della
piridina verso gli elettrofili è bassa. Le reazioni sono poche e avvengono a
temperature elevate:

4) Reazioni di
sostituzione nucleofila.
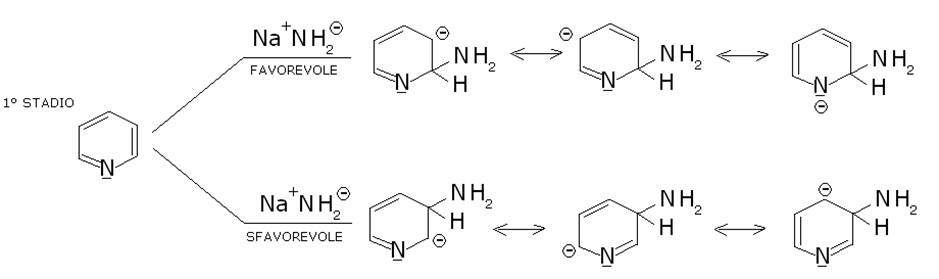
La
piridina subisce la sostituzione nucleofila per attacco di nucleofili molto
forti, a causa dell’effetto attivante dell’azoto dell’anello piridinico,
analogo a quello che esercita il nitrogruppo legato ad un anello benzenico.
Infatti sia l’azoto della piridina, sia il nitrogruppo
legato ad un anello benzenico, a causa dell’effetto elettronattrattore rendono
parzialmente positivo l’anello, soprattutto nelle posizioni orto e para,
favorendo quindi la sostituzione in queste posizioni.
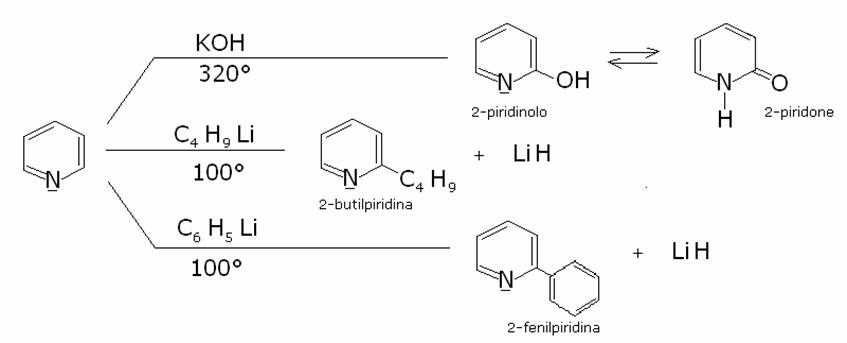
La piridina può essere amminata, idrossilata, alchilata, arilata. Comunque la scarsa reattività della piridina richiede in
ogni caso una elevata temperatura di reazione. Viene illustrato il meccanismo
della reazione di amminazione. Le altre sostituzioni, idrossilazione,
alchilazione, arilazione, decorrono con meccanismo analogo:

Torna a ARGOMENTI DI CHIMICA ORGANICA