"L'acqua e le sue proprietà "
Le proprietà dell'acqua
La vita nelle forme in cui la conosciamo non potrebbe esistere senza acqua. Tutte le cellule, sia di organismi acquatici che terrestri, contengono più del 70% di acqua. La sua molecola ha proprietà inusuali quando le si mettono a confronto con quelle di molecole simili in struttura o dimensione come NH3, HF or H2S.
-
Punto di ebollizione più alto
-
punto di fusione più alto
-
tensione superficiale più elevata
-
più alto calore di vaporizzazione
Tutte queste proprietà indicano che le interazioni tra le singole molecole d'acqua devono essere insolitamente più forti.
La struttura ed il legame ad Idrogeno
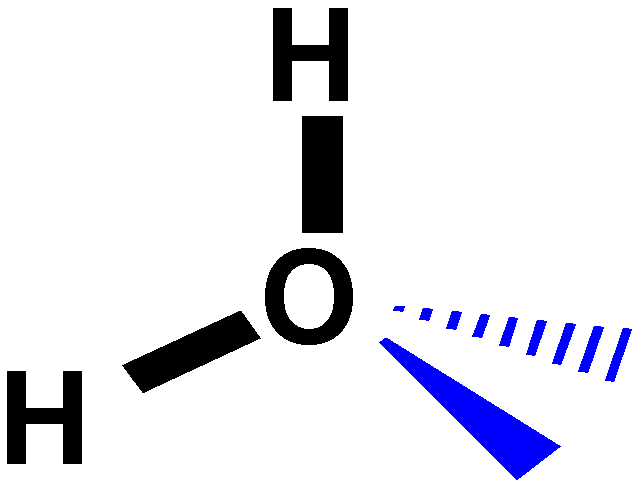 L'angolo
di legame della molecola d'acqua, 104,5° e la differenza di elettronegatività
tra H ed O conferisce una forte caratteristica ionica al legame OH che
comporta a sua volta un momento di dipolo elevato. La molecola d'acqua
è una molecola fortemente polare
L'angolo
di legame della molecola d'acqua, 104,5° e la differenza di elettronegatività
tra H ed O conferisce una forte caratteristica ionica al legame OH che
comporta a sua volta un momento di dipolo elevato. La molecola d'acqua
è una molecola fortemente polare
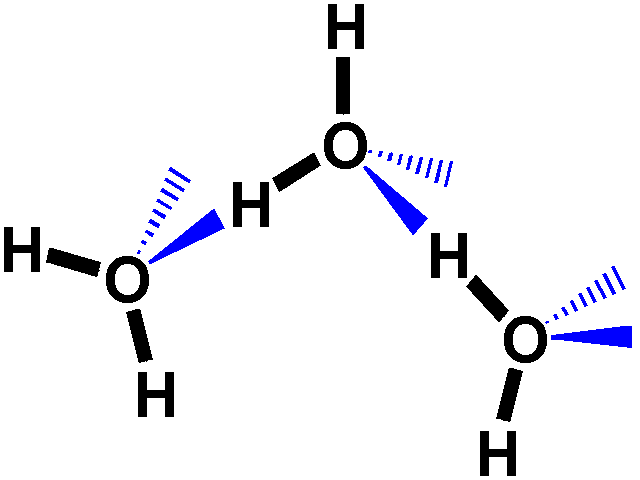 Le
proprietà uniche dell'acqua si originano dalle interazioni tra
l'H di una molecola e il doppietto solitario di elettroni di un'altra
molecola d'acqua. Questa interazione è chiamata legame ad idrogeno.
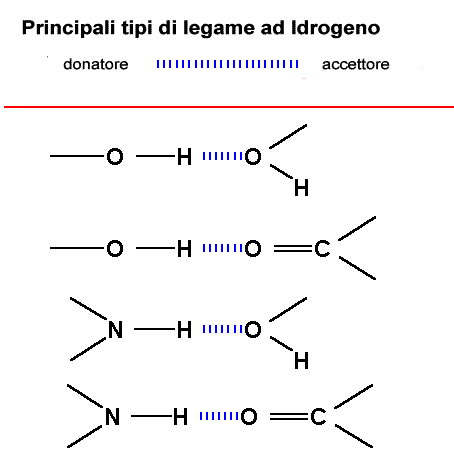
Queste interazioni possono originarsi in tutte le molecole in cui sia
presente un H su un gruppo donatore (-O-H or –N-H) ed un doppietto
solitario su un gruppo accettore (O=C, O-H). Importante è
che nel gruppo donatore ci sia un'appropriata differenza di elettronegatività
L'energia di un legame ad idrogeno è dell'ordine di @
20 kJ/mol mentre quella di un legame O-H è 460 kJ/mol. Esso è
comunque molto importante per le biomolecole dal momento che esse presentano
in genere molti legami ad idrogeno che conferiscono così alta stabilità
alla molecola. A causa della sua polarità l'acqua da buone interazioni
con gli ioni.
Le
proprietà uniche dell'acqua si originano dalle interazioni tra
l'H di una molecola e il doppietto solitario di elettroni di un'altra
molecola d'acqua. Questa interazione è chiamata legame ad idrogeno.
Queste interazioni possono originarsi in tutte le molecole in cui sia
presente un H su un gruppo donatore (-O-H or –N-H) ed un doppietto
solitario su un gruppo accettore (O=C, O-H). Importante è
che nel gruppo donatore ci sia un'appropriata differenza di elettronegatività
L'energia di un legame ad idrogeno è dell'ordine di @
20 kJ/mol mentre quella di un legame O-H è 460 kJ/mol. Esso è
comunque molto importante per le biomolecole dal momento che esse presentano
in genere molti legami ad idrogeno che conferiscono così alta stabilità
alla molecola. A causa della sua polarità l'acqua da buone interazioni
con gli ioni.
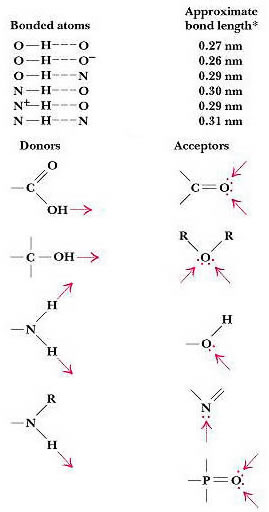 Dalla
tabella di fianco si può notare
Dalla
tabella di fianco si può notare
- come le lunghezze di legame ad iddrogeno siano misurate dall'atomo più elettronegativo del gruppo donatore all'atomo del doppietto solitario.
- diminuendo la differenza di elettronegatività nel gruppo donatore aumenta la distanza del legame ad idrogeno e diminuisce così la sua forza.
Si possono avere differenti gruppi donatori in Chimica Organica: tutti devono presentare un H legato ad un atomo molto elettronegativo; come pure per i gruppi accettori è importante la presenza di doppietti elettronici solitari non coinvolti in legami. Routine in chime
Proprietà colligative
 Le
proprietà colligative sono proprietà delle soluzioni, abbassamento
del punto di congelamento, innalzamento del punto di ebollizione e pressione
osmotica, che dipendono dal nmumero di particelle di soluto presenti.
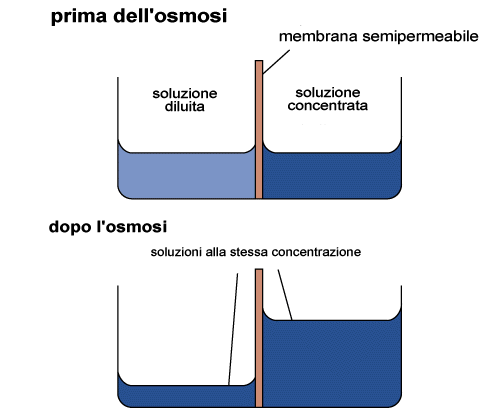
La pressione osmotica è particolarmente importante nei sistemi
biologici. Si sviluppa quando una membrana semipermeabile separa due soluzioni
una delle quali contiene un soluto che non può passare attraverso
la membrana, come accade nel caso di una cellula. L'acqua può attraversare
la membrana e lo farà passando nel compartimento dove è
presente il soluto non permeabile nel tentativo di uguagliare le attività
ad entrambo i lati della membrama. Come si vede dalla figura di seguito
questo causerà un aumento della colonna d'acqua sul lato che contiene
il soluto. Si definisce pressione osmotica (p)
la pressione da esercitare per impedire che la colonna d'acqua si innalzi.
Si dimostra che p=RTm
dove R è la costante dei gas, T la temperatura espressa in °K
m è la molalità, cioè moli di soluto/kg di solvente.
Le
proprietà colligative sono proprietà delle soluzioni, abbassamento
del punto di congelamento, innalzamento del punto di ebollizione e pressione
osmotica, che dipendono dal nmumero di particelle di soluto presenti.
La pressione osmotica è particolarmente importante nei sistemi
biologici. Si sviluppa quando una membrana semipermeabile separa due soluzioni
una delle quali contiene un soluto che non può passare attraverso
la membrana, come accade nel caso di una cellula. L'acqua può attraversare
la membrana e lo farà passando nel compartimento dove è
presente il soluto non permeabile nel tentativo di uguagliare le attività
ad entrambo i lati della membrama. Come si vede dalla figura di seguito
questo causerà un aumento della colonna d'acqua sul lato che contiene
il soluto. Si definisce pressione osmotica (p)
la pressione da esercitare per impedire che la colonna d'acqua si innalzi.
Si dimostra che p=RTm
dove R è la costante dei gas, T la temperatura espressa in °K
m è la molalità, cioè moli di soluto/kg di solvente.
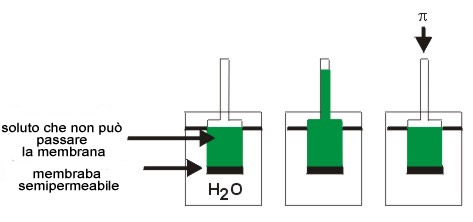 Per
una cellula, se l'acqua entra nella cellula la soluzione è detta
Ipotonica cioè la concentrazione delle sostanze disciolte è
minore nella soluzione che nella cellula. La cellula tenderà ad
espandersi ed eventualmente scoppiare.
Per
una cellula, se l'acqua entra nella cellula la soluzione è detta
Ipotonica cioè la concentrazione delle sostanze disciolte è
minore nella soluzione che nella cellula. La cellula tenderà ad
espandersi ed eventualmente scoppiare.
Se l'acqua esce dalla cellula, la soluzione è detta ipertonica cioè concentrazione delle sostanze disciolte è maggiore nella soluzione che nella cellula. La cellula si contrarrà.
Interazioni noncovalenti.
Le strutture e le propirietà delle biomolecole da cui dipende la vita, proteine, acidi nucleici, lipidi e caroidrati complessi, dipendono interamente dalle insolite proprietà dell'acqua e nessun un altro solvente ha propietà simili ad essa.
Le interazioni non covalenti fra biomolecole che sono essenziali al loro funzionamento dipendono interamente dalle proprietà dell'acqua.
-
Interazioni non covalenti sono molto più deboli (da 10 a 100 volte) del legame covalente.
-
E' proprio questa debolezza che li rende importanti, perchè significa che le interazioni noncovalenti sono continuamente formate e rotte nei processi dinamici che caratterizano la vita.
-
Le interazioni non covalenti coinvolgono cariche elettriche.
-
Queste interazioni elettriche possono esser dirette, come nelle interazioni ioniche e dipolo
-
Possoo essere indirette come in un dipolo indotto o ina dispersione forzata dove le alterazioni degli elettroni nelle molecole non polari sono la base dell'interazione.
-
Le interazioni di Vander Walls dipendono dagli elettroni dell'orbitale più esterno.
-
Il legame ad idrogeno è anche un legame non covalente.
La forza d'interazione fra due ioni è data dalla legge di Coulomb F=k[q1q2/e r2] dove si può vedere che essa è inversamente proporzionale ad s la costante dielettrica del solvente.
L'acqua ha un'alta costante dielettrica, il che significa che le interazioni ioiche in acqua sono molto deboli rispetto ad un altro solvente. Questo è dovuto al fatto che l'acqua solvata gli ioni attraverso interazioni carica dipolo.
Piccoli ioni in acqua possono influenzare le interazioni
biomolecolari, poteggendo le cariche effettive delle biomolecole.
La forza dell'effetto dei piccoli ioni è data (I) della soluzione
dove I=½S
MiZi2.do ve c è la
concentrazione degli ioni e Zi è la carica degli ioni in soluzione.
Molecole anfipatiche
Le molecole Polari o idrofile sono solubili in acqua poichè formano legami ad idrogeno con essa oppure interazioni di tipo ionico. Le molecole Idrofobe o apolari non avendo gruppi ionici non possono formare legami ad idrogeno. Inoltre la presenza di una molecola apolare in acqua causa le molecole d'acqua stesse ad organizzarsi attoreno alla molecola apolare per formare una struttura chiamata CLATRATO.
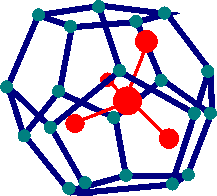
Questa struttura causa un aumento di ordine nell'organizzazione delle molecole d'acqua intorno ad essa con una corrispondente diminuzione di entropia che termodinamicamente non favorisce il processo. La combinazione di mancanza di favorevoli legami ad Idrogeno tra le molecole apolari e l'acqua e una variazione sfavorevole di Entropia spiegano perchè queste molecole apolari hanno una bassissima solubilità in acqua.
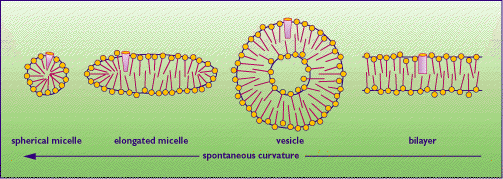
Si definiscono molecole anfipatiche quelle molecole che hanno una testa polare ed una coda idrofoba non polare.
Tali molecole hanno una "crisi di identità" nel senso che con la coda apolare non interagiscono favorevolemnete con l'acqua, mentre lo fanno con la testa polare, crisi che viene risolta con la formazione di monostrati, di micelle o di doppi strati.
Le molecole anfipatiche con una sola coda apolare ( sali di acidi grassi, detersivi) di solito formano le micelle, mentre molecole con due code polari (fosfolipidi) formano i doppi strati che a loro volta formano strutture chiuse dette vescicole. Le molecole anfipatiche a doppia coda apolare sono alla base della struttura delle membrabe cellulari.