legami chimici
1-i legami chimici tra atomi uguali o diversi danno origine alle molecole 2-i legami chimici sono collegati alla ridistribuzione degli elettroni dell'ultimo livello(elettroni di valenza) tra gli atomi che devono collegarsi 3-il tipo di legame che si forma dipende dalla diversa proprietą dei diversi elementi di perdere o acquistare elettroni per raggiungere la stabilitą con 8 elettroni nell'ultimo livello: tale proprietą (elettronegativitą) presenta valori numerici assegnati ai diversi elementi secondo una scala:dai pił elettropositivi(bassi valori di elettronegativitą:metalli) ai pił elettronegativi(alti valori di elettronegativitą:non metalli) 4-per convenzione si ammette che quando la differenza di elettronegativitą De supera il valore 1.9 o eguaglia 1.9 l'elemento meno elettronegativo cede i suoi elettroni e diventa un catione l'elemento pił elettronegativo acquista elettroni e diventa un anione
5-i tipi di legame chimico sono fondamentalmente tre:
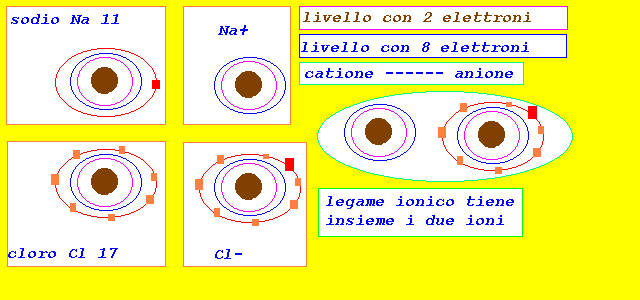
legame ionico o eteropolare
si verifica quando la De >= 1.9
si attua una cessione-acquisto di elettroni tra i due atomi
si stabilisce un legame elettrostatico tra i due ioni formatisi
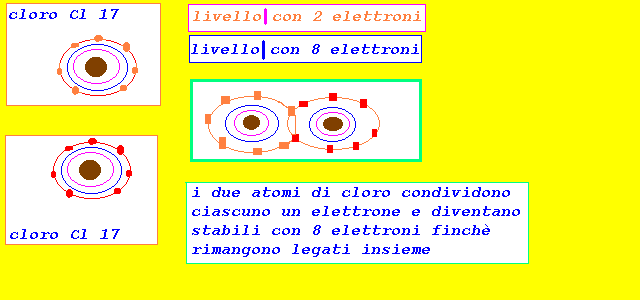
legame covalente
si verifica quando la De< 1.9
si attua mediante condivisione di elettroni tra i due atomi
possono presentarsi tre situazioni diverse:
De=0
il doppietto elettronico risulta simmetricamente condiviso
il legame risulta covalente omopolare
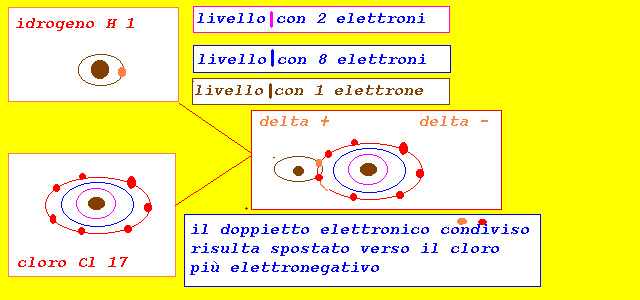
0 < De < 1.9
il doppietto elettronico risulta spostato verso elemento
pił elettronegativo (compare una parziale carica negativa,
e una parziale carica positiva)
il legame risulta covalente polare
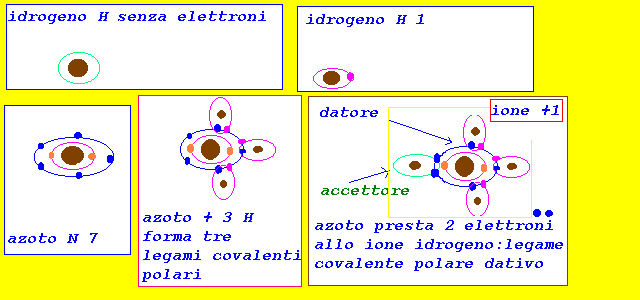
0 < De < 1.9
il doppietto elettronico risulta spostato verso elemento
pił elettronegativo (compare una parziale carica negativa,
e una parziale carica positiva)
il legame risulta covalente polare dativo
(in questo legame,un atomo condivide il doppietto elettronico
con un altro atomo che presenta solo l'orbitale vuoto
disponibile ad accettare due elettroni:donatore e accettore)
legame metallico:
consiste nella condivisione degli elettroni di valenza
di tutti gli atomi della massa metallica(es.Cu)con gli
ioni del metallo stesso(nube elettronica condivisa con
tutti gli atomi ionizzati)
legame
ionico o eteropolare
si verifica quando la De
>= 1.9
si attua una cessione-acquisto di elettroni tra i due atomi
si stabilisce un legame elettrostatico tra i due ioni formatisi

legame
covalente
si verifica quando la De< 1.9
si attua mediante condivisione di elettroni tra i due atomi
possono presentarsi tre situazioni diverse:
De=0
il doppietto elettronico risulta simmetricamente condiviso
il legame risulta covalente
omopolare
0 < De <
1.9
il doppietto elettronico risulta spostato verso elemento
pił elettronegativo (compare una parziale carica negativa,
e una parziale carica positiva)
il legame risulta covalente
polare
0 < De <
1.9
il doppietto elettronico risulta spostato verso elemento
pił elettronegativo (compare una parziale carica negativa,
e una parziale carica positiva)
il legame risulta covalente
polare dativo
(in questo legame,un atomo condivide il doppietto elettronico
con un altro atomo che presenta solo l'orbitale vuoto
disponibile ad accettare due elettroni:donatore e accettore)
legame
metallico:
consiste nella condivisione degli elettroni di valenza
di tutti gli atomi della massa metallica(es.Cu)con gli
ioni del metallo stesso(nube elettronica condivisa con
tutti gli atomi ionizzati)

valenza stechiometrica ed elettronica valenza