conducibilitÓ elettrica delle varie sostanze
scopo della esercitazione
verificare la diversa conducibilitÓ elettrica di varie sostanze e ricavare
eventuali leggi sulla conducibilitÓ elettrica delle soluzioni elettrolitiche
per definizioni e altre informazioni cfr.finestra
materiale fornito ai singoli gruppi di allievi
1-pila o generatore a corrente continua
2-lampadina o tester per verificare passaggio della corrente elettrica
3-sostanze varie da analizzare
4-contenitore di vetro per cella elettrolitica ed elettrodi di carbone o platino o rame
fase operativa : ricerca sulla conducibilitÓ elettrica delle varie sostanze
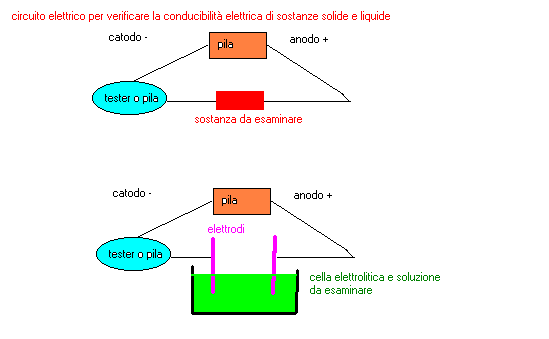
1-costruire un circuito come indicato nello schema
2-collegare gli estremi dei conduttori mediante sostanze varie e
...osservare se la corrente elettrica passa
3-riportare i dati delle osservazioni su una tabella
circuito da utilizzare

tabella dati osservati
sostanza..................conducibilitÓ
ferro.................................si
legno.......................no
rame.................................si
vetro.......................no
plastica...................no
sale.........................no
zucchero.................no
alcol........................no
acqua......................no
base NaOH.............no
acqua+sale.........................si
acqua+acido HCl................si
acqua+base NaOH.............si
acqua+zucchero.....no
acqua+alcol...........no
definiamo conduttrici le sostanze che conducono la corrente elettrica
definiamo non conduttrici le sostanze che non conducono la corrente elettrica
definiamo
elettroliti le sostanze che in soluzione acquosa conducono la corrente elettrica
non elettroliti le sostanze che in soluzione acquosa non conducono la corrente e.
in particolare:acidi,sali,basi risultano elettroliti
fase operativa : leggi della conducibilitÓ elettrica delle soluzioni elettrolitiche
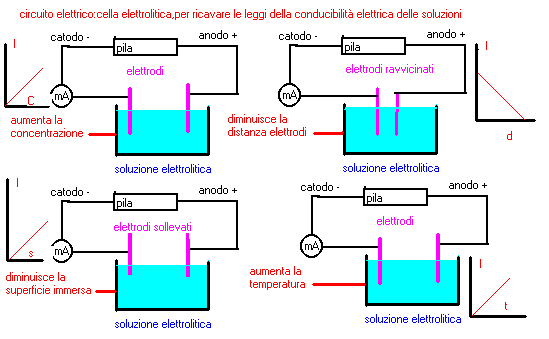
si rivelano significative 5 variabili:
concentrazione dell'elettrolita,distanza degli elettrodi,superficie immersa degli elettrodi,
temperatura della soluzione,natura degli elettroliti
nota:i valori sperimentali riportati sono puramente indicativi in funzione didattica
1-costruire il circuito come indicato in figura
2-riempire con acqua distillata ,fino a metÓ ,il contenitore di vetro
3-inserire i due elettrodi nel liquido e collegarli al generatore di corrente continua
4-osservare se passa corrente:prendere nota:non passa
5-versare poche gocce di elettrolita(HCl) e osservare,misurare se passa corrente
--aggiungere per alcune volte altro HCl fino al massimo della conducibilitÓ
...si osserva che la intensitÓ della corrente che attraversa il circuito,a paritÓ di altre
...condizioni,varia in proporzione alla concentrazione dell'elettrolita presente
...(con valori diversi avremmo avuto lo stesso comportamento usando altri elettroliti)
concentrazione in N.........0.1.........0.2........0.3......0.4.........0.5
intensitÓ corrente mA.....10...........20.........30.......40..........50
...di conseguenza si pu˛ generalizzare enunciando una prima legge:
...La conducibilitÓ di una soluzione elettrolitica,a paritÓ di altre condizioni,varia in
...funzione della concentrazione dell'elettrolita....:I =f(concentrazione) = f(c)
--vuotare il contenitore e versare ancora per metÓ acqua distillata e poche gocce di HCl
--allontanare e avvicinare gli elettrodi,sempre con uguale grado di immersione:si osserva
...che la intensitÓ di corrente che passa varia in funzione inversa alla distanza degli
...elettrodi,a prescindere dalla loro forma o natura
distanza elettrodi in cm...........50.......40.........30......20......10
intensitÓ di corrente in mA.....2.........4...........6........8........10
...si pu˛ quindi generalizzare enunciando una seconda legge della conducibilitÓ:
...La conducibilitÓ di una soluzione elettrolitica,a paritÓ di altre condizioni,varia in
...funzione inversa della distanza degli elettrodi....:I =f(inverso distanza) = f(1/d)
--vuotare il contenitore e versare ancora per metÓ acqua distillata e poche gocce di HCl
--sollevare o immergere gli elettrodi,sempre con uguale distanza:si osserva
...che la intensitÓ di corrente che passa varia in funzione della superficie immersa degli
...elettrodi,a prescindere dalla loro forma o natura
superficie immersa in cq.........10........20.......30.....40.....50
intensitÓ di corrente in mA......1.........2..........3......4.......5
...si pu˛ quindi generalizzare enunciando una terza legge della conducibilitÓ:
...La conducibilitÓ di una soluzione elettrolitica,a paritÓ di altre condizioni,varia in
...funzione della superficie immersa degli elettrodi....:I =f(superficie) = f(s)
--vuotare il contenitore e versare ancora per metÓ acqua distillata e poche gocce di HCl
--aumentare la temperatura della soluzione usando acqua riscaldata:si osserva
...che la intensitÓ di corrente che passa varia in funzione della temperatura della
...soluzione,a paritÓ di altri fattori
temperatura in gradi C..................10.......20.......30.......40.....50
intensitÓ di corrente in mA............2.........4........6..........8.......10
...si pu˛ quindi generalizzare enunciando una quarta legge della conducibilitÓ:
...La conducibilitÓ di una soluzione elettrolitica,a paritÓ di altre condizioni,varia in
...funzione della temperatura della soluzione....:I =f(temperatura) = f(t)
--vuotare il contenitore e versare ancora per metÓ acqua distillata
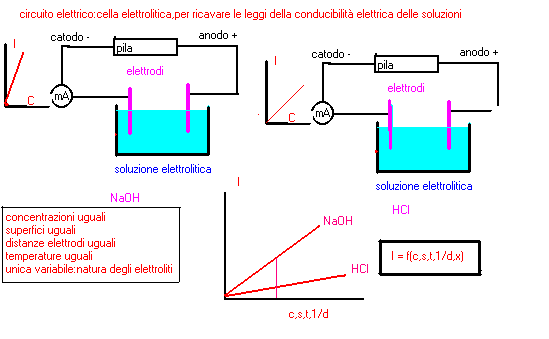
--introdure un nuovo elettrolita,es.NaOH,con la stessa concentrazione usata per HCl
--disporre gli elettrodi alla stessa distanza e con la stessa immersione come nel caso
--precedente con HCl e alla stessa temperatura:unica variante la natura dell'elettrolita:
...si osserva che la intensitÓ di corrente che passa varia in funzione della natura
...dell'elettrolita
intensitÓ di corrente in mA...................................................................
elettrolita HCl...........................1..........2..........3............4.................5
elettrolita NaOH......................2...........4..........6............8.................10
...si pu˛ quindi generalizzare enunciando una quinta legge della conducibilitÓ:
...La conducibilitÓ di una soluzione elettrolitica,a paritÓ di altre condizioni,varia in
...funzione della natura dell'elettrolita....:I =f(natura) = f(x)
in sintesi si pu˛ quindi affermare:
la conducibilitÓ elettrica di una soluzione varia in funzione diretta della concentrazione dell'elettrolita,della superficie immersa degli elettrodi,della temperatura della soluzione;in funzione inversa della distanza degli elettrodi:a paritÓ di condizioni varia in funzione della natura dell'elettrolita: I = f(c,s,t,1/d,x)
semplice ipotesi interpretativa per giustificare i dati osservati e le leggi ricavate
1-le sostanze non elettrolitiche hanno molecole neutre e tali rimangono in soluzione:non ...possono quindi favorire la circolazione della corrente elettrica
2-le sostanze elettrolitiche invece hanno molecole neutre che tuttavia se poste in ...soluzione acquosa possono separarsi(dissociarsi o ionizzarsi) in particelle cariche ...rispettivamente di segno positivo(cationi) o di segno negativo(anioni)
3-tali ioni migrano verso gli elettrodi di segno opposto:cationi verso catodo e anioni verso ...anodo,favorendo quindi(almeno in soluzione)un flusso di cariche elettriche trasportate ...da particelle cariche
4-il fenomeno che si verifica agli elettrodi(elettrolisi mediante ossidoriduzione) permette ...il trasferimento di cariche elettriche libere(elettroni) dal catodo all'anodo grazie alla ...azione del generatore di corrente(cfr.argomento pile,redox,elettrolisi).
se la ipotesi precedente Ŕ accettabile,si spiegano facilmente le leggi ricavate:
1-aumentando la concentrazione dell'elettrolita,aumentano gli ioni portatori di ...carica,quindi aumenta la intensitÓ della corrente misurata
2-diminuendo la distanza degli elettrodi,si rende pi¨ rapida,frequente,l'interazione tra ioni ....presenti in soluzione e superficie degli elettrodi:aumenta la corrente che passa
3-aumentando la superficie immersa degli elettrodi,si favorisce l'interazione tra ioni ...presenti in soluzione e superficie di scambio:aumenta la corrente che passa
4-aumentando la temperatura della soluzione,si aumenta la velocitÓ di spostamento degli ...ioni e quindi la frequenza delle interazione con elettrodi:aumenta la corrente che passa
5-modificando la natura degli elettroliti,cambia la intensitÓ della corrente che passa,se si ...ammette la ipotesi che i vari elettroliti possano dissociarsi in grado variabile,oppure ...generare un numero diverso di ioni,oppure generare ioni con carica diversa ..(cfr.finestra per spiegazioni ulteriori):esempio:
..100 NaOH -----> 100 Na(+1) + 100 OH(-1) ..100 HCl--->80 Na(+1) + 80 Cl(-1) + 20 HCl
..100 CaCl2------> 100 Ca(+2) + 200 Cl(-1)......100 NaCl-->100 Na(+1)+ 100 Cl(-1)
..100 AlCl3-------> 100 Al(+3) + 300 Cl(-1)