
ebollizione
passaggi di stato :ebollizione e condensazione riscaldando una sostanza pura liquida,si osserva un aumento della temperatura,che varia con la natura della sostanza, a parita di massa considerata continuando a fornire energia si nota che la temperatura non aumenta piu:la sostanza inizia la ebollizione e durante tutta la ebollizione la temperatura rimane costante quando tutta la sostanza risulta vaporizzata,la temperatura del vapore originato riprende ad aumentare se si fornisce altra energia. il fenomeno inverso avviene con la condensazione : il vapore cede calore e rigenera il liquido a temperatura costante temperatura che risulta uguale a quella di ebollizione processo di riscaldamento ed ebollizione: 1-il calore fornito alla sostanza mentre si trova allo stato liquido fa aumentare la energia cinetica delle particelle costituenti la sostanza e quindi si registra un aumento di temperatura proporzionale 2-il calore fornito alla sostanza mentre si verifica la ebollizione viene utilizzato per compiere un lavoro contro le forze che mantengono unite le particelle e quindi non si registra nessun aumento di temperatura restando costante la energia media della sostanza liquida e vaporizzata 3-il calore fornito alla sostanza completamente allo stato di vapore fa aumentare la energia cinetica delle particelle e quindi si registra un aumento di temperatura proporzionale processo di raffreddamento e condensazione 1-il calore ceduto dalla sostanza mentre si trova allo stato di vapore fa diminuire la energia cinetica delle particelle costituenti la sostanza e quindi si registra una diminuzione di temperatura proporzionale 2-il calore ceduto dalla sostanza mentre si verifica la condensazione viene sostituito da quello generato nella formazione dei legami che mantengono unite le particelle allo stato liquido:calore di condensazione non si registra nessuna diminuzione di temperatura restando costante la energia media della sostanza vaporizzata e liquida 3-il calore ceduto dalla sostanza completamente allo stato liquido fa diminuire la energia cinetica delle particelle e quindi si registra una diminuzione di temperatura proporzionale
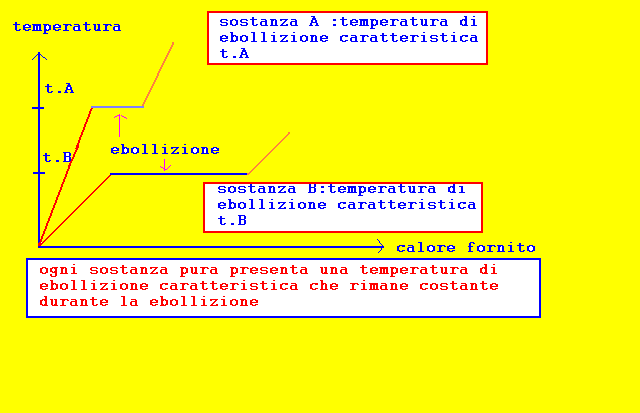
osservazioni sperimentali sul fenomeno della ebollizione e leggi della ebollizione una sostanza liquida assorbendo energia(calore) pu˛ trasformarsi in vapore,processo di vaporizzazione,in due modi diversi: evaporazione: -avviene solo sulla superficie del liquido a contatto con ambiente esterno -avviene in modo impercettibile -avviene ad ogni temperatura ebollizione: -avviene in tutta la massa del liquido riscaldato -avviene in modo visibile,tumultuoso -avviene ad una temperatura caratteristica per ogni sostanza leggi della ebollizione: 1-ogni sostanza pura presenta una temperatura di ebollizione caratteristica 2-durante la ebollizione la temperatura rimane costante 3-la ebollizione avviene quando la tensione del vapore Ŕ leggermente superiore di quella sovrastante il liquido riscaldato 4-la temperatura di ebollizione varia con la pressione esercitata dall'esterno:aumenta se aumenta la pressione e diminuisce se la pressione diminuisce. nota:la tensione di vapore corrisponde alla pressione esercitata dal vapore in equilibrio con il liquido generante(allo stato di saturazione): varia con la natura del liquido e con la temperatura:aumenta se aumenta la temperatura e diminuisce se la temperatura diminuisce. E' evidente quindi che se aumenta la pressione esterna,dovrÓ aumentare anche la tensione di vapore per ottenere la ebollizione:la tensione di vapore aumenterÓ se aumenterÓ la temperatura del liquido;viceversa, se la pressione diminuisce,sarÓ sufficiente anche una minore temperatura per raggiungere una tensione di vapore pi¨ ridotta.
interpretazione meccanismo della ebollizione: quando il liquido viene riscaldato si verifica il processo della evaporazione,a livello della superficie libera del liquido:ma anche all'interno della massa liquida avviene una evaporazione per la presenza di bollicine gassose incluse nel liquido:la evaporazione avviene liberando il vapore entro tali bollicine che vanno perci˛ aumentando di volume e arricchendosi di nuovo vapore:il vapore presente possiede una sua tensione che va aumentando con l'aumentare della temperatura e della concentrazione:le bollicine si gonfiano e diventano visibili e iniziano a portarsi verso l'alto per effetto della spinta idrostatica:giunte in superficie,se la tensione del vapore interno alle bollicine Ŕ pari o maggiore di quella esterna,le bollicine possono esplodere liberando il vapore contenuto:processo di ebollizione. E' evidente che se la pressione esterna aumenta,deve aumentare anche la tensione di vapore presente nelle bollicine,e questo richiede una maggiore temperatura del liquido:aumento della temperatura di ebollizione con aumento di pressione esterna;e viceversa...