

SCUOLA DI SPECIALIZZAZIONE IN MICROBIOLOGIA E VIROLOGIA
Direttore Prof. Alfredo Chiarini
IL GENERE ASPERGILLUS
Tesi di specializzazione di: Isabella Mancuso
Classificazione
tassonomica
|
|
Regno
|
Funghi
|
Phylum
|
Ascomycota
|
Ordine
|
Eurotiales
|
Famiglia
|
Trichocomaceae
|
Genere
|
Aspergillus
|
Tutti gli Aspergilli sono
saprofiti diffusi in ogni ambiente tanto da risultare fra i più comuni contaminanti delle
colture microbiche.
La relativa rarità dell’infezione
nell’uomo è giustificata dal carattere tipicamente opportunistico della malattia.
Tutte gli Aspergillus sono
caratterizzati dalla loro particolare modalità di riproduzione conidiale: presenza di un
conidioforo (detto anche stipe terminante con un rigonfiamento denominato vescicola; su
quest’ultima si formano le fialidi, o direttamente o attraverso una serie di corte
cellule sterili dette metulae (Sterigmates); ogni fialide produce una catena di
spore ramificate; l’insieme della vescicola, delle fialidi e delle spore prende il
nome di testa aspergillare.
Anche se la maggior parte degli aspergilli non presenta la forma di riproduzione sessuale, alcuni di essi sono in grado di produrre delle formazioni sessuate dette cleistoteche contenenti degli aschi ad 8 ascospore.
Nel genere è incluso un gran numero di specie (185), raccolte in ben 18 gruppi, la cui chiave analitica di identificazione sfrutta caratteristiche colturali diverse:
·
macroscopiche: morfologia e
colore della colonia (tab. 1);
·
microscopiche: morfologia
delle teste aspergillari (fig. 1), morfologia delle fialidi e della vescicola, presenza o
meno di metulae, forma e dimensione dei conidi (tab. 2).
Specie
|
Colore della colonia
|
Morfologia
|
A. fumigatus
|
Verde con un bordo bianco |
Margini netti a superficie granulare, con abbondante produzione di spore pigmentate |
A. niger
|
Bianco con punteggiatura nera (teste aspergillari) o colorazione pepe e sale |
Margini irregolari, abbondante micelio aereo fioccoso |
A. nidulans
|
Verde o giallo-verde |
Margini irregolari, superficie fioccosa |
A. flavus
|
Giallo
|
Margini netti, abbondante micelio aereo fioccoso |
A. terreus
|
Marrone
|
Margini irregolari, micelio cotonoso |
Tab. 1. Caratteristiche macroscopiche dei principali Aspergilli di interesse medico.
Specie
|
Vescicole
|
Fialidi
|
Conidiofori
|
A. fumigatus
|
Clavate, fertili nei 2/3 distali |
Serie unica |
Lisci |
A. niger
|
Sferiche, fertili su tutta la superficie |
Serie unica o duplice |
Lisci
|
A. nidulans
|
Emisferiche, fgertili sui 2/3 distali |
Serie duplice |
Lisci |
A. flavus
|
Piriformi o sferiche |
Serie unica o duplice |
Rugosi |
A. terreus
|
Emisferiche |
Serie duplice |
Lisci |
Tab. 2. Caratteristiche microscopiche dei principali Aspergilli di interesse medico.
Forma delle teste
aspergillari |
A. niger
Globulosa
|
A. fumigatus
Cilindrica
|
A. nidulans
Tozza
|
A. flavus
Radiata
|
A. terreus
Semisferica
|
Fig. 1. Forme delle teste conidiali dei principali Aspergilli di interesse medico.
2. Cenni storici
Il nome Aspergillus fu dato per la prima volta dal prete Micheli nel 1729, il quale, osservando delle particolari muffe, notò una forte somiglianza di esse con l’aspersorio dell’incenso (Aspergillum in latino), di cui si serviva in chiesa..
Nel 1809, fu Link a dare il nome di Aspergillus glaucus ad un fungo trovato in un erbario, descrivendo le prime forme sessuate sotto il nome di Eurotium herbariorum.
Per attribuire un ruolo patogeno al
genere Aspergillus si dovette aspettare il 1847, quando Sluyter pubblicò i
primi casi di pneumopatia umana dovuta ad un Aspergillus.
Le ricerche su tale genere diventarono
man mano più numerose e nel 1926 Thom e Church pubblicarono il primo libro:
“The Aspergilli”, classificando 69 specie in 11 gruppi.
Nel 1945 venne pubblicato il libro
“A manual of the Aspergilli” di Thom e Raper, nel quale
furono classificati 14 gruppi contenenti 80 specie e 10 varietà.
Nel 1965 Raper e Fennel pubblicarono
“The genus Aspergillus”, contenente 18 gruppi e 132 specie e più tardi,
nel 1979, fu Samson ad aggiungere alla già copiosa lista altre 45 nuove specie.
Una nuova classificazione è stata
pubblicata da Pitt nel 1989 e a tutt’oggi
sono state identificate più di 185 specie, di svariato interesse.
Alcune specie sono utilizzate nell’industria
per la fermentazione di salse a base di soia, per la produzione del sakè da alcool di
riso o per la sintesi di diversi acidi organici, come l’acido citrico prodotto dalla A
niger a partire dalla melassa.
Numerose specie producono tossine
dannose per l’uomo; la più conosciuta, l’aflatossina prodotta dall’A.
flavus, si sviluppa notoriamente sulle arachidi ed è cancerogena.
3. Epidemiologia
Gli Aspergilli sono delle muffe
ubiquitarie presenti nell’ambiente.
Vivono a spese della materia organica in decomposizione e si sviluppano dentro ai silos, al compost, alle balle di fieno ma anche nei cereali e su diverse piante. Alcune specie termotolleranti si riscontrano più frequentemente nelle regioni tropicali.
Le spore hanno un tallo e una
morfologia (tonde, rugose da 2 a 3 mm di diametro ) tali da favorire sia la
loro disseminazione, poiché minore è l’attrito con i movimenti dell’aria, sia
il loro passaggio attraverso il tratto respiratorio fino agli alveoli polmonari, dove
possono provocare micosi primarie, particolarmente in individui immunodepressi o
compromessi.
I ceppi riconosciuti patogeni sono oggi
circa una ventina ed appartengono per oltre il 90% alla specie A. fumigatus, in
ragione della sua termotolleranza a 37 °C.
L’incidenza dell’aspergillosi
invasiva è incrementata drammaticamente nell’ultimo ventennio: l’esame delle
autopsie ha rivelato un aumento dallo 0,4% degli anni ‘70 al 4 % degli anni ’80.
Un recente studio di laboratorio ha
mostrato un’incidenza dell’aspergillosi invasiva di 12,4 casi per milione in un
anno.
Nonostante tutti gli sforzi diagnostici
e terapeutici l’aspegillosi invasiva è di esito spesso fatale: l’intervallo di
mortalità va dal 50 al 100 % nei casi studiati.
Quindi le misure preventive rivestono
un ruolo di importanza primaria nel controllo di questa patologia e richiedono una piena
conoscenza dell’epidemiologia di questa malattia devastante.
E’ certo che anche l’aria,
così come l’acqua, giochino un ruolo cruciale nell’incremento dell’incidenza:
le spore rilasciate nell’ambiente possono rimanere in sospensione per lunghi periodi,
contaminando tutto ciò che ne viene a contatto. E’ stato ipotizzato che l’inalazione
del pulviscolo atmosferico contenente spore di Aspergillus, sia direttamente che
indirettamente attraverso la colonizzazione nasofarigea, è la causa principale delle
infezioni polmonari nei pazienti immunocompromessi o neutropenici, che hanno un’alta
probabilità di sviluppare l’aspergillosi invasiva. Le spore delle specie patogene
più comuni di Aspergillus appartengono alle specie A fumigatus ,A. flavus ed
A. terreus con un diametro che va dai 2 ai 5 mm.
4. Patogenesi
Negli ultimi anni il ruolo patogeno di
alcuni Aspergilli è aumentato notevolmente, sia nei pazienti “a rischio”:
leucemici, trapiantati d’organo, immunodepressi e sottoposti a terapie
immunosoppressive; sia in soggetti sensibilizzati alle spore. Non trascurabile risulta
anche il ruolo patogeno esercitato dalle micotossine prodotte da questo micete.
Fra i fattori di virulenza un ruolo
importante è svolto in molti casi dalle stesse dimensioni del tallo fungino, che sono
spesso maggiori di quelle delle cellule fagocitarie, dei leucociti neutrofili in
particolare.
In molti altri casi, le dimensioni
della spora e del tubulo germinativo iniziale non sono così grandi da impedirne la
fagocitosi, ma l’energia meccanica del conidio in germinazione risulta però tale da
spingere l’ifa in accrescimento al di fuori del fagocita, perforandone la parete. L’abituale
accumulo di cellule fagocitarie (granulociti neutrofili e macrofagi) attorno alle ife in
accrescimento non riesce perciò a distruggerle o a circoscrivene durevolmente la
diffusione.
4.1. Aspergillosi
L’inalazione di spore di Aspergillus
può risultare molto comune, ma la malattia è relativamente rara. L’invasione del
tessuto polmonare è limitata a soggetti immunodepressi.
Circa il 90% dei soggetti che si ammalano hanno due tra le seguenti tre condizioni:
1. meno di 500 granulociti per ml di
sangue periferico;
2. dosi soprafisiologiche di
corticosteroidi;
3. storia di assunzione di farmaci
citotossici.
L’infezione è caratterizzata in questi soggetti da invasione dei vasi sanguigni da parte delle ife, trombosi, necrosi ed infarto emorragico.
4.1.1. Danni polmonari
Aspergilloma
Il termine aspergilloma si
riferisce ad una formazione tondeggiante di ife all’interno di una cisti polmonare o
di una cavità, di solito nel lobo superiore. Infatti, il micete prolifera in una cavità
prodotta nel polmone da malattie che hanno colpito il paziente negli anni precedenti
(tubercolosi, sarcoidosi).
Qualsiasi malattia polmonare in grado
di provocare lesioni cavitarie nel polmone predispone il soggetto a sviluppare un
aspergilloma, a seguito di proliferazione di spore fungine nella cavità preformata e
formazione di un gomitolo di filamenti fungini (ife). Una volta sviluppatosi l’aspegillo
inizia a secernere prodotti tossici e allergenici che inducono uno stato di alterazione
delle condizioni generali dei pazienti. Talvolta, specialmente nelle prime fasi di
sviluppo dell’aspergilloma, questi malati non mostrano sintomi clinici, ma poi
iniziano a presentare perdita di peso, tosse cronica e debolezza, che rappresentano i più
comuni sintomi tardivi. Espettorazione di sangue (emottisi) può manifestarsi nel 50-80%
dei soggetti colpiti. La diagnosi si basa sulla radiografia o sulla tomografia assiale
computerizzata del torace e su test specifici su sangue.
L’Aspergillus può diffondersi ad interessare la pleura in seguito a formazione di ascessi od a manipolazioni chirurgiche, oppure può colonizzare l’albero bronchiale danneggiato in pazienti con sottostanti patologie polmonari. Formazioni tondeggianti di ife all’interno di cisti o cavità possono raggiungere molti centimetri di diametro e possono essere visibili all’esame radiologico (fig. 2).
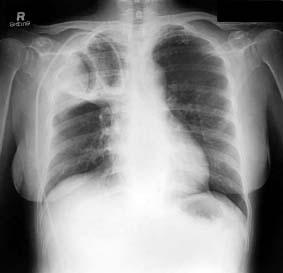
Fig. 2. Radiografia toracica mostrante aspergilloma polmonare da Aspergillus spp.
Aspergillosi polmonari endobronchiali
Si manifestano con tosse produttiva
cronica e spesso emottisi in un paziente con una precedente patologia cronica polmonare,
come ad esempio tubercolosi, sarcoidosi, bronchiectasie od istoplasmosi.
Le aspergillosi polmonari endobronchiali si classificano in:
·
Bronchite aspergillare
muco-membranosa:
relativamente rara, questa affezione è causata dallo sviluppo aspergillare in un bronco
che può anche terminare con l’ostruzione totale del medesimo.
·
Aspergillosi bronco-polmonare
allergica (ABPA): E’
una condizione caratterizzata da allergia alle spore dell’aspergillo, abbastanza
comune nei soggetti asmatici. Oltre il 20% di questi presenta sensibilizzazione alle spore
dell’aspergillo nel corso della sua vita. L’ABPA è frequente nei soggetti
affetti da fibrosi cistica adolescenti o adulti. I sintomi sono simili all’asma e
consistono in episodi intermittenti caratterizzati da malessere, tosse e dispnea; alcuni
soggetti espettorano zaffi di muco di colore marrone o rosso bruno. La diagnosi può
essere radiologica o avvalersi dell’analisi dell’espettorato, di campioni
ematici o di test di reattività cutanea. A lungo termine l’ABPA, se non trattata,
può provocare danni polmonari permanenti (fibrosi polmonare).
Aspergillosi bronco-polmonare diffusa
o invasiva (API).
E’ un’infezione nosocomiale
che colpisce principalmente i soggetti immunodepressi ed in fase di neutropenia prolungata
(trapiantati di midollo o di organo, etc.) ma anche in seguito a cortico-terapia.
L’Aspergillus si sviluppa
nel parenchima polmonare, nei bronchi e nei vasi. La manifestazione è una polmonite acuta
ed ha la tendenza a formare cavità o noduli. L’infezione diffonde per via ematogena
o per interessamento delle zone contigue, sino ad invadere il cervello, il cuore o la
cute. Solitamente questo e’ un brutto segno poichè tale condizione è più severa
con maggior rischio di morte per il paziente. La prognosi è quasi sempre infausta con una
mortalità superiore all’80%: molti pazienti con riduzione delle difese immunitarie
muoiono in seguito ad aspergillosi invasiva. La loro speranza di sopravvivenza è
strettamente dipendente dalla precocità della diagnosi, ma sfortunatamente i test
diagnostici sono poco sensibili e spesso la terapia deve essere iniziata quando l’aspergillosi
invasiva è solo sospettata. Il sospetto va posto clinicamente di fronte a una persona con
immunodeficienza dovuta a trapianto di midollo osseo, leucopenia a seguito di terapia
antineoplastica, AIDS, ustioni estese o alla malattia granulomatosa cronica (una rara
malattia ereditaria), che ha febbre e segni e sintomi respiratori (tosse, dolore toracico,
dispnea) che non rispondono alla terapia antibatterica. Gli esami radiologici del torace
sono solitamente alterati ed aiutano a localizzare la patologia (fig. 3). La broncoscopia
viene spesso utilizzata per la conferma della diagnosi.
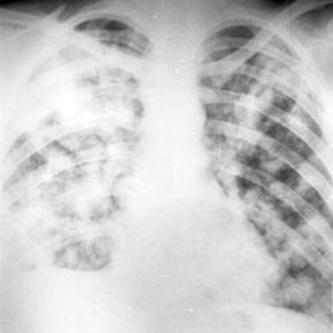
Fig. 3. Radiografia toracica mostrante opacità bilaterale con noduli caratteristici dell’aspergillosi polmonare invasiva.
4.1.2. Danni extra-polmonari
Sinusite aspergillare
L’aspergillo può localizzarsi nei
seni paranasali delle ossa facciali, dando luogo a sinusite aspergillare con evoluzione
simile a quella dell’aspergilloma. Nei soggetti con normale competenza immunologica
causa congestione nasale, mal di testa cronico e dolore al volto. Il drenaggio chirurgico
del seno solitamente risolve il problema, a meno che l’aspergillo non abbia
colonizzato i seni profondi del cranio (etmoidali); in questo caso la chirurgia deve
essere accompagnata da farmaci antifungini per avere successo. Nei pazienti con riduzione
delle difese immunitarie, quali quelli che ad esempio hanno avuto una leucemia o sono
stati sottoposti a un trapianto di midollo osseo, la sinusite da aspergillo è più grave
e va considerata come una forma di aspergillosi sistemica. I sintomi includono febbre,
dolore alla faccia, secrezioni nasali e mal di testa. In un soggetto immunodepresso (AIDS)
può assumere due forme: una raccolta di ife può formarsi in un seno paranasale
cronicamente ostruito, senza che vi sia invasione tessutale; molto più raramente può
iniziare un’infiammazione cronica fibrosante di tipo granulomatoso da ife di Aspergillus
intratessutale a livello dei seni e diffondersi poi lentamente all’orbita ed al
cervello.
La diagnosi viene stabilita mediante l’identificazione
del fungo nelle secrezioni nasali o nei tessuti del seno mascellare, mediante rinoscopia.
Otomicosi
Con il termine di otomicosi si intende
la crescita dell’Aspergillus su cerume e detriti a livello dell’orecchio
esterno.
Cheratite
Si manifestano più soventemente in soggetti portatori di lenti a contatto o in seguito a traumi della cornea.
Endocardite
L’Aspergillus può infettare protesi intracardiache od intravasali, in seguito ad intervento chirurgico.
Super-infezione di piaghe
A. fumigatus, più soventemente,
può svilupparsi su ustioni o piaghe con coinvolgimento cutaneo, ritardando la
cicatrizzazione o aggravando il quadro clinico.
4.2. Spore e allergie
Allergia deriva da due parole
greche: allos che significa diverso, ergon che significa effetto. Quando
si parla di allergia si intende perciò la reattività spontanea ed esagerata dell’organismo
del soggetto allergico a particolari sostanze, che risultano invece innocue nell’80%
della popolazione.
I termini ipersensibilità ed
allergia sono comunemente usati come sinonimi. Le malattie allergiche sono malattie
atopiche, la cui caratteristica è la presenza di una particolare classe di anticorpi
specifici (IgE). Per atopia si intende la tendenza ereditaria alla reazione di
ipersensibilità mediata da anticorpi IgE.
L’individuo allergico, quando
viene a contatto con determinate sostanze, innocue per altri individui, sviluppa una
risposta immunitaria abnorme. Le sostanze in grado di stimolare la reazione allergica
vengono dette allergeni. L’allergene è infatti considerata una sostanza
dotata di potere antigene, cioè tale da provocare la produzione di anticorpi quando entra
nell’organismo.
Gli allergeni possono provocare una
reazione allergica penetrando nell’organismo secondo diverse modalità: più
comunemente per via aerea (come ad esempio le polveri ed i pollini), per via alimentare,
per via topica, per via iniettiva.
I meccanismi d’azione della
reazione allergica sono complessi. Semplificando, si può dire che la prima esposizione ad
un allergene causa una modesta reazione: l’allergene viene riconosciuto come estraneo
dall’organismo dai macrofagi tessutali che li fagocitano, i prodotti di
degranulazione (istamina) stimolano i linfociti T helper e questi a loro volta inducono i
linfociti B a produrre IgE. Questa fase viene detta di sensibilizzazione.
L’istamina è la sostanza
responsabile della caratteristica reazione allergica: vasodilatazione, aumento della
permeabilità dei vasi (arrossamento della cute), pomfo (rilievo cutaneo arrossato),
reazione pruriginosa. La liberazione di grandi quantità di istamina può indurre shock
anafilattico (caduta della pressione, pallore, tachicardia, sudorazione, angioedema
delle vie aree superiori, difficoltà a respirare, collasso circolatorio, morte).
Le spore di Aspergillus spp.
sono sostanze allergizzanti. Infatti, in soggetti predisposti, le spore di questo micete
possono causare fenomeni allergici.
L’aria presente negli ambienti
domestici, ma anche nelle sale operatorie, se pure accuratamente filtrata, può agire in
maniera allergizzante, nonostante sia comprovato che i filtri trattengono tutti i
microrganismi, compresi i miceti e le loro spore. Infatti, non sono solo le spore che
determinano fenomeni allergici, ma anche gli enzimi secreti.
Umidificatori, vaporizzatori, terra per
fiori, pareti umide e rivestimenti per superfici in legno costituiscono il serbatoio per
le spore di Aspergillus spp.
4.3. Le aflatossine
4.3.1. Cenni storici
Le micotossine sono delle
sostanze tossiche naturali di muffe e funghi, e possono formarsi in presenza di
determinate condizioni climatiche (caldo e umidità). Si diffondono in tutti i Paesi in
cui queste condizioni si verificano. Alla fine degli anni ‘40, nell’allora
Unione Sovietica, morirono degli operai che lavoravano nei silos di stoccaggio delle
granaglie. Dei tecnici fecero accurati rilevamenti sui corpi e all’interno dei
depositi, trovando abbondanti tracce di muffe altamente tossiche di formazione naturale,
che avevano contaminato le vie aeree degli operatori.
La scoperta degli effetti tossici di
queste muffe spiegò per alcuni anche le morti improvvise in cui incorsero alcuni
archeologi egizi, come Lord Carnavon, che nel 1922 fu stroncato da una misteriosa
broncopolmonite fulminante, poche ore dopo avere scoperto la tomba del «faraone
giovinetto».
Nel 1960, in Inghilterra, una terribile
moria colpì gli allevamenti di tacchini uccidendo circa centomila capi, e originando un
disastro economico. Vennero mobilitate le strutture scientifiche e sanitarie e le indagini
individuarono la causa di tutto nella presenza di funghi tossigeni all’interno di
mangimi a base di arachidi. I funghi comparvero poi in allevamenti di bovini, suini,
anatre, portando all’identificazione di altri metaboliti tossici da funghi
responsabili di gravi patologie in grado, in alcuni casi, di portare rapidamente il
bestiame alla morte. Si trattava di quelle che, in seguito, si scoprirono essere le
micotossine più tossiche: le aflatossine del genere Aspergillus.
Le aflatossine sono dei metaboliti
secondari prodotti nel micelio, in particolare dall’Aspergillus flavus.
Le aflatossine sono delle sostanze che
agiscono legandosi al DNA ed impedendo di conseguenza tutte le sintesi macromolecolari.
Hanno anche azione cancerogena. Sono responsabili di intossicazioni di vari animali
domestici, nutriti con alimenti nei quali si sia moltiplicato il micete produttore di
aflatossine. Tracce di aflatossina sono state ritrovate nel latte e nei latticini ottenuti
da bovini alimentati con foraggi contaminati, per cui non è esclusa la possibilità di
intossicazioni alimentari umane.
Le aflatossine conferiscono alla muffa
che le produce un vantaggio competitivo nei confronti di altre muffe o dei batteri. Sono
associate alle spore della muffa ma anche al suo corpo (micelio) ed al substrato sul quale
la muffa produttrice di tossine si è sviluppata, esercitando il loro effetto tossico
indipendentemente dal grado di vitalità della struttura (spora o micelio) che le
contiene.
Possono esercitare effetti sulla salute
umana ed in particolare a carico del fegato, del rene e del sistema nervoso a seguito di
esposizione per ingestione (apparato digerente), contatto cutaneo (pelle) ed inalazione
(vie respiratorie). Entrano nelle vie respiratorie dell'uomo in forma di aerosol e ciò si
verifica quando le spore, o le altre strutture che possono contenerle, vengono disperse
nell'aria.
Le aflatossine sono le micotossine più
pericolose per la salute umana ed animale. Sono prodotte dalle specie A. flavus
(aflatossine B1 e B2) e A. parasiticus (aflatossine B1, B2, G1 e G2).
La temperatura ottimale di crescita per
questi funghi è di circa 25°C (sebbene possano crescere a temperature comprese tra 6 e
46°C); il loro sviluppo è, inoltre, favorito da un’umidità relativa dell’aria
pari o superiore all’85% .
La più importante fra le micotossine
è l’Aflatossina B1 prodotta dall’A. flavus. È questa la sostanza
cancerogena più potente presente in natura ed agisce anche in senso epatotossico. È
presente nelle nocciole, noci, pistacchi, mais, semi di zucca ed altri frutti e semi
oleosi. In seguito all’assunzione di tali sostanze, le quali per vari motivi vanno
incontro ad ammuffimento, si può riscontrare l’aflatossina nel latte, nelle uova,
nel fegato e nella carne degli animali. Procedimenti quali la cottura, o l’acidificazione
non determinano la distruzione di questa, come di altre micotossine. Esperimenti
effettuati sui ratti hanno dimostrato che la tossicità di tale sostanza è simile a
quella della stricnina.
Anche le altre aflatossine possono ritrovarsi in numerosi prodotti alimentari, quali semi oleosi granaglie frutta secca e spezie soprattutto se originari dei paesi tropicali e subtropicali.
Il latte e i prodotti lattiero-caseari
possono contenere aflatossina M1 cioè il 4-idrossi derivato dell’aflatossina
B1 come conseguenza della conversione metabolica dell’aflatossina B1 alla quale le
vacche da latte sono esposte mediante l’alimentazione con mangimi contaminati. Quando
questo latte viene sottoposto a un processo di caseificazione si ha un fenomeno di
concentrazione delle aflatossine che ne aumenta la tossicità. Una di queste aflatossine
si chiama roquefortina, data la sua presenza nei formaggi cosiddetti “blu”,
come il roquefort o il gorgonzola.
Una volta assorbite hanno effetti
epatotossici negli animali e nell’uomo e alcune di esse sono potenti cancerogeni o
hanno effetti teratogeni, in grado cioè di creare malformazioni nei feti.
Ma le aflatossine sono presenti anche
nelle carni degli animali e da queste, come dal latte, cioè dal metabolismo degli animali
produttori, possono essere espulse solo naturalmente, con il tempo.
All’inizio si stentò a realizzare la pericolosità del fenomeno ma in trent’anni di studi si è arrivati a sapere molto di più sulle possibili conseguenze negative per la salute umana e animale, come sui danni economici, di notevole portata sia per i coltivatori che per gli allevatori. Solo da poco si è cominciato a legiferare e a emanare regolamenti, ponendo limiti alla presenza di micotossine in diversi prodotti agroalimentari, per uso umano, animale, e per i filati come il cotone, anch’esso vittima delle colonie di miceti. Attualmente la Comunità Europea, la Food and Drugs Administration e 77 Governi di tutto il mondo hanno emesso regolamentazioni in materia.
5. Diagnosi
Come nelle altre malattie da infezione
anche nelle Aspergillosi la diagnosi deriva fondamentalmente dall’indagine
microbiologica. La dimostrazione microscopica e/o colturale di Aspergillus resta
tuttora la prova diagnostica principale, tuttavia importanti indicazioni possono essere
fornite dalle ricerche sierologiche.
Il ripetuto isolamento dell’Aspergillus
dall’escreato, o la dimostrazione di ife nell’escreato o in campioni di lavaggio
bronchiale, suggerisce la colonizzazione endobronchiale o l’infezione. Anche un
singolo isolamento di Aspergillus dall’escreato di un paziente neutropenico
affetto da polmonite, soprattutto se non fumatore o bambino, deve far ipotizzare la
diagnosi di aspergillosi invasiva.
Formazioni rotondeggianti di ife a
livello polmonare sono evidenziabili alla radiografia del torace. Anticorpi della classe
IgG verso gli antigeni dell’Aspergillus sono dimostrabili nel siero di molti
pazienti colonizzati dal fungo e di quasi tutti i pazienti con formazioni tondeggianti
polmonari.
La biopsia è spesso necessaria per
fare diagnosi di aspergillosi invasiva del polmone, dei seni paranasali o di altri siti di
disseminazione. Emoculture sono raramente positive, anche in pazienti con protesi
cardiache infette. Le ife dell’Aspergillus possono essere identificate
presuntivamente dall’istologia, ma l’esame colturale è richiesto per la
conferma diagnostica e per la determinazione della specie.
5.1. Diagnosi micologica
Modalità di raccolta, trasporto e
conservazione dei campioni
Tutti i campioni biologici, i materiali di laboratorio e le colture per l’isolamento dell’Aspergillus devono essere considerati come potenzialmente infettivi e quindi maneggiati secondo le norme di sicurezza previste.
L’isolamento colturale e la successiva identificazione dei miceti dai materiali biologici dipende dalle corrette procedure di raccolta e di trasporto dei campioni. Tutti i materiali biologici devono essere raccolti in contenitori sterili, inviati al laboratorio ed inoculati su terreni colturali appropriati entro breve tempo dall’arrivo. Qualora l’esame non possa essere eseguito nei tempi richiesti, il campione deve essere conservato a 4°C fino al momento dell’inoculo, ad eccezione dei campioni dermatologici (15-30°C).
Di seguito vengono indicate le modalità di raccolta relative ai principali materiali biologici.
Ø Campioni oculari: le probabilità di isolamento di Aspergillus dal materiale oculare sono incrementate sensibilmente dalla possibilità che il campione venga inoculato su appropriati terreni colturali immediatamente dopo il prelievo. Il materiale corneale, raccolto con apposite spatole (platino) dalle aree ulcerate o suppurate, deve essere trasferito sulla superficie di una piastra di agar Sabouraud e, possibilmente, utilizzato in parte per indagini microscopiche.
Ø Cute. I campioni cutanei vengono prelevati, dopo disinfezione con alcool al 70%, raschiando i margini periferici della lesione, con un bisturi od un vetrino sterile e raccogliendo le scaglie in una piastra Petri sterile.
Ø Fluidi da cavità chiuse (liquido pleurico, peritoneale, sinoviale): il materiale viene prelevato utilizzando provette eparinate sterili, per evitare una eventuale coagulazione. Il materiale non purulento può essere concentrato mediante centrifugazione (2500 rpm x 15 min.), in modo da sottoporre a coltura il sedimento ottenuto (0,1 - 0,5 ml).
Ø Sangue: i campioni di sangue per l’emocoltura solo in rari casi sono di scelta per la diagnosi di aspergillosi. Poichè la probabilità di isolamento aumenta con il volume di sangue testato e dato che la fungemia può essere intermittente, si consiglia di prelevare almeno due campioni di sangue distanziati tra loro di almeno 30 minuti. In caso di utilizzo di un sistema bifasico, il sangue viene inoculato direttamente in due bottiglie contenenti 0,025 % di sodio polietanol sulfonato e terreno di coltura (BHI, Trypticase soy broth). Se il laboratorio è dotato di apparecchiature automatiche per l’emocoltura, i campioni devono essere inoculati negli appositi flaconi al momento del prelievo: qualora il sistema lo preveda, si consiglia l’utilizzo di brodi specifici per l’isolamento dell’Aspergillus.
Ø Fibroscopia bronchiale: si può fare un’aspirazione del lavaggio bronchiale, endobronchiale e alveolare oppure una biopsia polmonare.
Ø Escreato e lavaggio bronchiale: si può ridurre il numero dei batteri contaminanti orofaringei facendo fare dei gargarismi con acqua prima di effettuare il prelievo Nei casi in cui la produzione di escreato sia scarsa, l’induzione con soluzione fisiologia nebulizzata mediante un apparato inalatore a pressione può essere un mezzo efficace per ottenere un campione più rappresentativo delle vie aeree inferiori
Ø Tessuti: i campioni bioptici (o autoptici) devono essere prelevati sterilmente sia dalla zona centrale che dai bordi della lesione, raccolti in una provetta contenente soluzione fisiologica sterile (o, in alternativa, una piastra Petri contenente della garza sterile inumidita con soluzione fisiologica sterile). Per facilitare l’isolamento colturale, si consiglia di omogeneizzare il materiale e di inocularlo sui terreni colturali.
Indagini microscopiche
Possono essere utili per selezionare adatti terreni di coltura e possono fornire al medico indicazioni per una rapida diagnosi presuntiva di aspergillosi.
Dall’esame microscopico si osservano ife relativamente piccole (3-6 mm) e regolari, ramificate dicotomicamente con angoli di 45° e con setti distinti. Talvolta si può osservare la presenza di teste aspergillari.
L’esistenza di spore senza filamenti non ha alcun significato clinico, ma non necessariamente la presenza di singoli filamenti è sinonimo di aspergillosi.
Nei materiali patologici
Molti materiali inviati al laboratorio per l’esame colturale possono essere sottoposti ad esame microscopico “a fresco” per la ricerca di elementi fungini tipici del genere Aspergillus. Questo esame deve essere eseguito in associazione, e non in sostituzione, all’esame colturale. A tale scopo si può utilizzare l’esame microscopico a fresco con idrossido di potassio (KOH) al 10%. Le sostanze organiche, che spesso possono simulare una morfologia fungina all’osservazione microscopica a fresco, vengono chiarificate dal trattamento con soluzioni alcaline moderatamente concentrate. Gli elementi fungini presenti, invece, non vengono intaccati e possono essere individuati abbastanza facilmente. Il campione viene emulsionato con KOH su un vetrino portaoggetti, riscaldato alla fiamma e, dopo 10-15 min, previa aggiunta di un vetrino coprioggetto, osservato al microscopio.
Nelle sezioni istologiche
Si effettuano dopo colorazioni particolari che evidenziano le strutture cellulari fungine.
Le colorazioni istologiche più utilizzate sono:
- Acido periodico di Schiff (PAS)
- Argento-metenamina secondo Gomori-Grocott (GMS).
La prima colorazione è specifica per le aldeidi; nella parete fungina, queste si formano da polisaccaridi presenti (glucani e mannani), grazie al pre-trattamento della sezione istologica con acido periodico o analoghi, che rompono i legami tra gruppi ossidrilici adiacenti.
La specifica reazione di ciascuna dialdeide, così formata con i due radicali solforosi, anch’essi adiacenti, di una molecola di acido fucsin-solforoso (Reattivo di Schiff), prodotto incolore della reazione fra cloruro di pararosanilina ed acido solforoso, porta alla formazione per assestamento molecolare interno di una molecola chinonica provvista di doppi legami ed intensamente colorata in rosso Magenta.
Alla reazione non partecipa la componente chitinosa della parete perché priva di gruppi ossidrilici adiacenti.
Nell’altro metodo, assai diffuso (Gomori-Grocott) la reazione di ossido-riduzione tra i gruppi aldeidici, prodotti con modalità analoghe negli stessi polisaccaridi, ed il complesso metenamina-nitrato di argento, riduce quest’ultima ad argento metallico che evidenzia nettamente il contorno dei talli fungini, colorandone in nero la tunica.
Entrambi i metodi consentono di evidenziare la presenza di elementi fungini nelle sezioni di tessuto. Si deve segnalare, tuttavia, che non rappresentano colorazioni specifiche per i miceti, bensì per la componente polisaccaridica cellulare, potendo di conseguenza dare luogo ad artefatti.
Esame colturale
E’ sempre di fondamentale importanza, sia perché può risultare positivo anche in caso di negatività della ricerca microscopica, sia perché quest’ultima non fornisce, salvo eccezioni, elementi certi per l’identificazione del micete.
I campioni destinati all’esame colturale devono essere inoculati su appropriati terreni che devono consentire la crescita degli Aspergilli.
Attualmente, si possono utilizzare una grande varietà di terreni contenenti antibiotici (per ridurre al massimo la sovracrescita da parte della flora batterica presente) ma non cicloesimide (Actidione), che ne inibirebbe la crescita.
La temperatura ottimale di incubazione per l’A. fumigatus è di 37°C, mentre tutte le altre specie preferiscono quella di 27°C.
I tempi di incubazione variano a seconda della specie ma solitamente vanno da 48 a 72 h.
Di seguito vengono citati alcuni dei terreni di più frequente utilizzo in campo, per l’isolamento degli Aspergilli:
Ø Agar
Destrosio di Sabouraud (SDA)
E’ il terreno normalmente utilizzato per l’isolamento primario dei miceti, spesso con aggiunta di antibiotici come cloramfenicolo e/o gentamicina. Tale terreno consente la rilevazione della morfologia "standard", non permettendo le migliori condizioni di crescita o di sporulazione.
Ø Agar
infuso cuore-cervello (BHI)
Può essere utilizzato per l’isolamento di muffe, ma anche di lieviti, che richiedono terreni più ricchi; l’aggiunta di antibiotici, quali il cloramfenicolo, può essere utile per prevenire la sovracrescita batterica.
Ø Agar
patata-destrosio (PDA)
Viene utilizzato soprattutto per stimolare la produzione di conidi da parte dei miceti filamentosi, risultando utile per l’identificazione mediante la tecnica della coltura su vetrino.
Ø Agar
all’estratto di malto (MEA)
Terreno impiegato per l'isolamento e la determinazione di lieviti e muffe, in particolare negli alimenti, nel latte e nei suoi derivati; è utilizzato anche per l’isolamento, l'identificazione e il mantenimento degli Aspergilli.
Ø Terreno
di Czapek
E’ un terreno povero, costituito da una soluzione contenente vari sali, a cui viene aggiunto del saccarosio. Viene utilizzato per studi tassonomici e morfologici. Il terreno può essere impiegato per indurre la riproduzione di conidi da parte di Aspergillus spp.
5.2. Diagnosi sierologica
La ricerca a scopo diagnostico degli anticorpi umorali specifici, che trova così largo impiego nelle infezioni batteriche e virali è ostacolata nelle micosi dalla particolare frequenza di reazioni crociate a causa di strette correlazioni antigeniche fra molti miceti patogeni.
Il perfezionamento delle metodiche sierologiche, specie per quanto riguarda la purificazione degli antigeni, ha permesso tuttavia di allestire una serie di saggi sierologici di notevole sussidio diagnostico.
Modalità di raccolta
Siero: i campioni di sangue vengono prelevati, raccolti in provette sterili e lasciati coagulare a temperatura ambiente per almeno 15 minuti. Successivamente il campione viene centrifugato ed il siero raccolto in provette sterili. Se l’esame non può essere eseguito entro 4-6 ore dal prelievo, il campione può essere conservato a 2-8°C per 3-4 giorni, mentre per conservazioni più lunghe il siero deve essere conservato in congelatore a temperatura £ -20°C (si consiglia di utilizzare congelatori senza sbrinamento automatico). Nel caso si utilizzino metodiche semi-quantitative o per monitorare lo status sierologico del paziente si possono prelevare campioni seriati, distanziati di alcuni giorni tra loro: in questo caso i campioni successivi dovrebbero essere testati contemporaneamente al primo campione.
Ricerca di anticorpi
La diagnosi sierologica è preziosa per la conferma di aspergilloma o d’ABPA. Nei casi di API sfortunatamente, essa è generalmente negativa o troppo tardivamente positiva per avere un qualsiasi interesse.
Per la ricerca di anticorpi nell’aspergillosi possono essere utilizzate numerose tecniche:
Ø saggio di immuno-diffusione: risulta assolutamente specifico, purché sia eseguito il confronto con antisieri di riferimento. Pur essendo A. fumigatus la specie più frequentemente coinvolta, è di uso comune l’utilizzazione di antigeni appartenenti anche alle specie A. flavus, A. niger, A. terreus, e A. nidulans, che talvolta possono essere causa di infezione, mostrando un certo grado di specificità sierologia. Nei soggetti immunodepressi (leucemici, AIDS, etc.) con possibile difetto di produzione anticorpale, la previa concentrazione del siero (5X) può sensibilizzare il test.
Ø Immuno-elettroforesi: l’antigene utilizzato è un antigene somatico e metabolico di A. fumigatus; il test prevede la ricerca di catalasi e chimotripsina nelle bande di precipitazione.
Ø Immuno-fluorescenza (IF):la reazione si fa avvenire tra gli anticorpi del paziente e l’antigene ottenuto da rene di coniglio inoculato precedentemente con Aspergillus .
Ø ELISA (Enzyme Linked Immuno Sorbent Assay) : sfrutta il riconoscimento dell'antigene aspergillare da parte di un anticorpo specifico; il complesso antigene-anticorpo viene rivelato da uno specifico saggio enzimatico.
5.3. Identificazione
5.3.1. Esame macroscopico delle
colture
Le colture vanno esaminate ogni 2-3 giorni per rilevare eventuali segni di crescita fungina. Le colonie devono essere esaminate sulla superficie superiore, annotando il colore e la consistenza. All’inizio della crescita la colonia appare bianca ma con la comparsa delle spore essa assume la colorazione tipica di ogni specie: bianca, ocra, bruna, nera o con diverse tonalità di verde e qualche volta gialla.
5.3.2. Esame microscopico delle
colture
Successivamente all’esame macroscopico, viene effettuato l’esame microscopico per osservare le seguenti strutture aspergillari (fig. 4):
Ø il
conidioforo: liscio o rugoso, di dimensione variabile, dritto o sinuoso, incolore o
con varie tonalità di bruno, a volte settato;
Ø la
vescicola: di forma variabile: assai allungata, perfettamente globulare, semisferica,
oppure appiattita all’estremità.
Ø le fialidi: formate direttamente sulla vescicola o sulle metulae; (sterigmati), ricoprono tutta la vescicola o solamente la parte superiore.
Ø i conidi: lisci o verrucosi, tondi o allungati.
Ø la testa aspergillare: in colonna lunga o corta, radiale o irregolare.
Ø le cleistoteche: si possono notare accanto alle teste aspergillari di alcuni ceppi definiti perciò omotallici. Sono di massa gialla o bruna formata da tessuto filamentoso compatto. Dalle cleistoteche mature fuoriescono 8 ascospore (piccoli elementi unicellulari gialli o rossi).
Le osservazioni di queste soprindicate strutture si possono effettuare anche dopo colorazione su vetrino.
|
|
Fig. 4. Schema delle più comuni teste aspergillari
Allestimento dei preparati per l’esame
microscopico con soluzione di blu di lattofenolo
L’osservazione delle caratteristiche microscopiche degli Aspergilli risulta di fondamentale importanza per giungere al riconoscimento del microrganismo, consentendo, attraverso una dettagliata analisi di tutte le componenti strutturali, l’identificazione a livello di Genere e di Specie.
Poiché formano colonie di consistenza tenace, il loro esame microscopico richiede spesso la preventiva dissezione di un frammento in soluzioni chiarificanti, di cui quella di più largo impiego, allo stesso tempo chiarificante e colorante, è il cosiddetto blu di lattofenolo.
Aiutandosi con un ago o con un’ansa ad uncino, si preleva una porzione di colonia, ponendola su una goccia di blu di lattofenolo, precedentemente posta su un vetrino portaoggetto. Con l’aiuto di due aghi, si cerca di suddividere la massa miceliare in porzioni ridotte.
Il tutto viene coperto con un vetrino coprioggetto ed osservato al microscopio (meglio se a contrasto di fase) a basso (100x) e medio (400x) ingrandimento. Questo metodo, sebbene di veloce esecuzione, non sempre consente di conservare l’esatta morfologia e la disposizione dei conidi, per cui può essere necessario ricorrere ad altre tecniche.
Vetrino con nastro adesivo
E’ un secondo metodo, di veloce esecuzione, per la preparazione di vetrini per l’osservazione microscopica degli Aspergilli. Si taglia un pezzo, lungo 3-4 cm, di nastro adesivo trasparente e, aiutandosi con due pinzette, si tocca la superficie della colonia per far aderire una porzione della stessa allo strato adesivo. Successivamente si posiziona il nastro su una goccia di blu di lattofenolo, si copre il tutto con un vetrino coprioggetto e si osserva al microscopio (meglio se a contrasto di fase) a basso (100x) e medio (400x) ingrandimento. Il metodo può essere utilizzato solo con colture in piastra, però, se eseguito correttamente, permette spesso di mantenere inalterata la morfologia dei microrganismi.
Coltura su vetrino
Rappresenta, in assoluto, la tecnica migliore per l’allestimento dei preparati per l’osservazione microscopica, soprattutto se si vogliono poi conservare i vetrini. Purtroppo non rappresenta un metodo rapido, perché si deve permettere al micete di crescere e di sviluppare la corretta morfologia. In breve, si taglia un blocco di terreno agarizzato di circa 1 cm, lo si pone su un vetrino portaoggetto sterile e lo si inocula su ogni lato con una porzione di colonia. Dopo aver coperto il blocco di agar con un vetrino coprioggetto, il tutto viene incubato in un contenitore (di solito una piastra Petri) umidificato ed incubato a 30° C. Il preparato viene esaminato periodicamente per rilevare la presenza di crescita, in alcuni casi osservandolo a basso ingrandimento (100x). Quando le strutture riproduttive sono formate, con una pinzetta si rimuove delicatamente il vetrino coprioggetto, a cui rimarrà adesa parte della colonia, e lo si pone su un secondo vetrino portaoggetto su cui è stata distribuita una goccia di blu di lattofenolo. Successivamente, con l’aiuto di un ago o di un’ansa ad uncino, si elimina il blocco di agar, buttandolo in un contenitore contenente del disinfettante. Sul vetrino portaoggetto rimarrà una seconda porzione di colonia, che può essere colorata con una goccia di blu di lattofenolo e coperta con un vetrino coprioggetto. Si ottengono così due preparati, che possono essere successivamente sigillati con dello smalto trasparente per unghie o con del fluido di montaggio, per permettere la conservazione dei vetrini per ulteriori osservazioni o a scopo didattico. I vetrini vengono osservati al microscopio (meglio se a contrasto di fase) a basso (100x) e medio (400x) ingrandimento.
6. Terapia
Non è sempre agevole poter raccogliere campioni di tessuto adeguati per la diagnosi (biopsie, bronco-aspirati, etc.) in un soggetto neutropenico e trombocitopenico o immunodepresso. Alcune indagini radiologiche consentono tuttavia di documentare la presenza di quadri abbastanza suggestivi, tali da consentire un inizio di terapia antifungina, mentre rimangono fondamentali le metodiche di diagnostica micologiche e sierologiche.
Comunque, in qualunque situazione, l’anfotericina B resta il farmaco di riferimento per il trattamento delle micosi da Aspergillus spp. nei soggetti con malattia neoplastica, neutropenici ed immunodepressi.
La dose singola giornaliera è di 0.8 mg/kg/die, ma la durata della terapia rimane imprecisata (questo trattamento è accettato anche per i pazienti che ricevevano profilassi con anfotericina B e.v. a basse dosi). Comunque, da un punto di vista strettamente farmacologico, poichè l’attività fungicida dell’anfotericina B sembra essere dose-dipendente, è verosimile che la somministrazione di dosi più elevate possa risultare più efficace. Inoltre, contrariamente a quanto avviene per la terapia in altri casi di malattie invasive, come la candidosi profonda, l’associazione anfotericina B con 5-Fluorocitosina, raramente risulta efficace nel trattamento delle aspergillosi invasive.
La pratica clinica suggerisce che il trattamento sequenziale anfotericina B - itraconazolo sembra essere efficace per le aspergillosi, così come la somministrazione contemporanea di anfotericina B intranasale e itraconazolo sistemico è risultata efficace nel trattamento di soggetti con aspergillosi nasale.
L'intervento chirurgico di asportazione della massa micotica (aspergilloma), quando possibile, può rappresentare una ulteriore opzione terapeutica e dovrebbe essere preso in considerazione in pazienti con sinusite o polmonite da Aspergillus dopo stabilizzazione del quadro clinico. Anche pazienti con emottisi severa dovuta alla presenza di massa micotiche polmonari possono beneficiare di lobectomia.
6.1.
Aspergillosi broncopolmonare allergica
La terapia degli episodi asmatici
prevede l’utilizzo di steroidi per via aerosolica o per os. L’itraconazolo
è utile al fine di ridurre il dosaggio di cortisonici efficace per controllare l’attacco
asmatico, al fine di limitare gli effetti collaterali della terapia cortisonica a lungo
termine, quali osteoporosi, aumento ponderale, distrofia cutanea.
6.2.
Aspergilloma
Il tipo di trattamento dipende da
diversi fattori, in particolare dalla presenza di emottisi e dalle condizioni del polmone.
In linea generale la terapia medica, con itraconazolo per via orale (400 mg al giorno)
può alleviare la sintomatologia, ma raramente è in grado di eliminare il micete dalle
cavità. La terapia chirurgica con rimozione del segmento polmonare interessato può
essere necessaria soprattutto in caso di emottisi frequenti ed abbondanti. Infine l’amfotericina
B, può essere iniettata direttamente nella cavità polmonare mediante un sondino inserito
in anestesia locale. Una scarsa percentuale di pazienti (10% circa) migliora senza
trattamento.
6.3.
Sinusite aspergillare
La terapia con potenti antifungini è
essenziale (amfotericina B). L’asportazione chirurgica è utile nella maggior parte
dei casi per eradicare il fungo.
6.4.
Aspergillosi invasiva
La terapia prevede l’utilizzo di
antifungini come l’amfotericina B e/o l’itraconazolo. L’amfotericina B deve
essere somministrata endovena ad alte dosi e in alcuni pazienti ciò danneggia il rene o
altri organi. Recentemente sono state prodotte nuove preparazioni dell’amfotericina B
(Amphocil, Abelcet, AmBisome) utili, soprattutto in pazienti che abbiano già presentato
effetti collaterali al Fungizone, perché meno tossiche. Anche l’itraconazolo può
essere utile, somministrato per os (ad alte dosi, almeno 400 mg al giorno). Prima
inizia il trattamento maggiori sono le speranze di sopravvivenza del paziente. In pazienti
con basso numero di leucociti il recupero di tali cellule può essere importante per il
blocco dell’infezione fungina. Talvolta è necessaria anche la chirurgia. Comunque,
circa un terzo dei pazienti con aspergillosi invasiva sopravvive se trattato, ma nessuno
sopravvive senza opportuna terapia. Tutte queste malattie possono colpire i bambini e
dovrebbero essere diagnosticate e trattate nella stessa maniera. Numerose ricerche, con
risultati preliminari incoraggianti, sono in corso per accelerare la diagnosi dell’aspergillosi
invasiva e per migliorarne il trattamento. Alcuni nuovi farmaci antifungini sono
attualmente studiati in lavori clinici controllati.
7. Profilassi
Per quanto riguarda la chemioprofilassi, al momento nessun farmaco può fornire una copertura completa contro gli Aspergilli.
È stato dimostrato che il fluconazolo può prevenire le infezioni da Candida ma non da Aspergillus, in pazienti sottoposti a trapianto di midollo.
In alcuni casi la profilassi è stata eseguita con successo somministrando bassi dosaggi di amfotericina B (cosiddetta ampho-light), anche se la tossicità di questo farmaco può costituire un problema.
L’Itraconazolo risulta essere efficace contro Aspergillus, tuttavia in uno studio prospettico, randomizzato, in doppio cieco in pazienti leucemici, il farmaco somministrato alla dose di 400 mg/die non ha ridotto né l'incidenza di aspergillosi documentate o sospette, né l'uso empirico di amfotericina B.
Questo potrebbe essere correlabile con i bassi livelli plasmatici di questo farmaco che si ottengono in pazienti con grave mucosità.
La profilassi della riattivazione di una precedente infezione da Aspergillus può essere eseguita con somministrazione di itraconazolo e/o amfotericina B (in talune situazioni anche combinata: ad esempio amfotericina B intranasale e itraconazolo sistemico).
8. Aspergilli patogeni
8.1. Aspergillus flavus
Colonia
|
Epidemiologia e ruolo patogeno
Micete molto diffuso in natura, si isola soprattutto dai suoli delle regioni tropicali e subtropicali, dalle granaglie e da diversi prodotti alimentari. Riveste un ruolo assai importante nell’industria per la produzione di enzimi proteolitici.
E’ molto patogeno per l’uomo. Spesso responsabile di patologie polmonari, è il secondo, dopo A. fumigatus, ad essere implicato nelle API. Può provocare anche cheratiti e otiti esterne. Produce una micotossina (aflatossina) cancerogena per il topo e ugualmente responsabile nel favorire lo sviluppo del carcinoma epatico umano.
Diagnostica micologica
Ø Esame
macroscopico:
- colonia aerea, polverosa di colore dal giallo-verde al verde oliva;
Ø Esame
microscopico:
- testa aspergillare radiale o in colonna;
- conidioforo incolore, discretamente rugoso;
- vescicola emisferica di dimensioni variabili;
- 1 o 2 file di sterigmati ricoprenti l’intera vescicola;
- conidi globulari, lisci o rugosi;
- presenza di sclerote rosso-bruno scuro o nere.
8.2. Aspergillus fumigatus
Colonia
|
Epidemiologia e ruolo patogeno
E’ particolarmente abbondante su tutti i suoli e sul materiale organico in decomposizione.
Grazie alla sua termotolleranza cresce bene su tutte le piante in rapida decomposizione in cui le reazioni sono esotermiche. Sopravvive fino a 55°C.
Molti antibiotici sono stati estratti da questo micete.
E’ l’Aspergillus che più frequentemente causa patologie umane ed animali.
E’ responsabile di circa il 90% delle malattie polmonari aspergillari, qualche volta associate ad A.flavus.
Diagnostica micologica
Ø Esame
macroscopico:
-
cresce molto rapidamente;
da 24 a 48 h ,alla temperatura di 37°C,da 48 a 72 h a 27°C; colonie piatte,
polverose,inizialmente di colore verde, assumono color grigio fumo dopo qualche giorno.
Ø Esame
microscopico:
- testa aspergillare in lunga colonna;
- conidioforo lungo, liscio,incolore o leggermente verde soprattutto nella parte terminale;
- vescicola semisferica, appiattita alla sommità;
- una sola fila di fialidi molto strette, regolari, sulla metà superiore o sui ¾ della vescicola;
- conidi globulari e rugosi;
8.3. Aspergillus nidulans
Colonia
|
Epidemiologia e ruolo patogeno
Specie largamente distribuita nel mondo, è principalmente isolata dal suolo delle regioni temperate e subtropicali.
E’ un micete principalmente responsabile di sinusiti. Si ritrovano forme sessuate nei tessuti malati.
Diagnostica micologica
Ø Esame
macroscopico:
- colonia polverosa, piatta, di colore verde;le cleistoteche sono frequenti e hanno l’aspetto di punti gialli sulla colonia;
Ø Esame
microscopico:
- testa aspergillare in colonna corta;
- conidioforo, molto corto, dai 60 ai 200 mm, sinuoso e di colore bruno assai intenso;
- vescicola semisferica, di colore ugualmente bruno;
- due serie di sterigmati,situati sulla parete superiore della vescicola, di lunghezza equivalente;
- conidi globulari, da 2,5 a 4 mm di diametro;
- cleistoteche assai frequenti; di colore bruno-rosso.
8.4. Aspergillus niger
Colonia
|
Epidemiologia e ruolo patogeno
Questo micete, ubiquitario, si ritrova su una grande varietà di substrati: granaglie, foraggio, frutti e legumi ammuffiti, prodotti caseari, cotone.
E’ molto utilizzato nell’industria: serve principalmente per la produzione dell’ acido citrico, ma anche per la produzione di altri i acidi organici come l’ acido gluconico e ossalico.
Fitopatogeno, è responsabile della putrefazione delle arachidi e di altre piante.
In patologia si ritrova soventemente nelle otiti esterne, ma anche, più raramente, di malattie polmonari.
Diagnostica micologica
Ø Esame
macroscopico:
- colonia aerea, granulosa, di color giallo all’inizio della crescita, poi nera.
Ø Esame
microscopico:
- testa aspergillare radiale;
- conidioforo bruno, liscio, largo;
- vescicola perfettamente globulare, dall’incolore al bruno chiaro;
- 1 o 2 fili di sterigmi a seconda dei tipi che ricoprono tutta la vescicola.Nelle colonie un po’ vecchie, è spesso difficile riuscire in ragione del numero di spore che restano adese sulla superficie della vescicola.
- conidi globulari o ellittici, lisci ;
8.5. Aspergillus terreus
Colonia
|
Epidemiologia e ruolo patogeno
Questo micete ubiquitario è isolato dalla superficie degli alberi secchi, soprattutto nelle zone calde, ma da un gran numero di substrati (granaglie, cotone e altri materiali fibrosi).
E’ utilizzato per la produzione di acido itaconico a partire da zucchero di canna o di barbabietola.
E’ raramente isolato dall’uomo, ma può essere responsabile di patologie nei pazienti leucemici o trapiantati, nei quali può provocare API.
Diagnostica micologica
Ø Esame
macroscopico:
- colonia polverosa, piatta, dal beige al bruno scuro.
Ø Esame
microscopico:
- testa aspergillare in colonna assai lunga;
- conidioforo liscio, incolore;
- vescicola emisferica;
- 2 serie di sterigmi inseriti nella parte superiore della vescicola;
- conidi piccoli, globulari, lisci.
Per la bibliografia contattami: borntoliveinlab@libero.it