| Struttura Chimica, Caratteristiche Fisico-Chimiche e Genesi
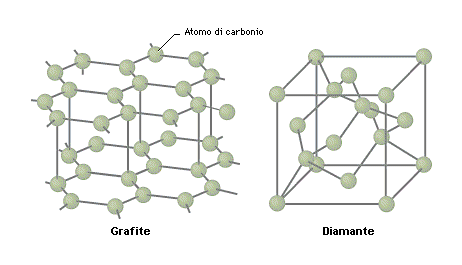
• DIFFERENZE TRA GRAFITE E DIAMANTE
I diamanti fanno parte del gruppo del carbonio, nel quale sono comprese varie modificazioni presenti in natura, essenzialmente riconducibili a due tipi fondamentali: grafite e diamante. Queste modificazioni si trovano allo "stato solido", ovvero una sostanza cristallina nel quale esiste una disposizione ordinata delle unità costituenti la sostanza (gruppi di atomi, molecole, ioni detti nodi) che si ripetono periodicamente nello spazio lungo una direzione(filare). Più filari disposti parallelamente determina un “piano reticolare”; più piani reticolari, disposti lungo le tre direzioni dello spazio, formano un reticolo cristallino. Entrambi i reticoli cristallini, della grafite e del diamante sono formati da atomi tutti legati fra loro con legami covalenti. Com’è noto il legame covalente trova la sua spiegazione più semplice nel fatto che due atomi mettono in “comune” alcuni elettroni periferici che risultano, per così dire, in comproprietà tra due atomi ed assicurano così un'interazione attrattiva fra essi. Possiamo inoltre avere dei legami covalenti ibridi sp2 come per la grafite, oppure dei legami covalenti puri come nel caso del diamante. La presenza di legami covalenti estesi a tutta la struttura e in tutte le direzioni spiega le eccezionali caratteristiche di stabilità di queste strutture.
È stato osservato come di regola sia inopportuno parlare di molecole nel caso di solidi cristallini, infatti strutture in cui sia possibile individuare delle unità pluri-atomiche corrispondenti a molecole sono caratterizzate da una coesione piuttosto debole, che si traduce in bassi valori della durezza e del punto di fusione. Questo complesso di proprietà viene attribuito alla scarsa interazione coesiva che si realizza fra molecola e molecola mentre ovviamente possono risultare anche molto forti i legami all'interno della molecola. Un classico esempio di questa struttura è quello della grafite che forma più lamelle esagonali appiattite nella cui struttura gli atomi di carbonio giacciono in una serie di piani paralleli, disposti ai nodi di un reticolato a maglie esagonali. Di conseguenza la struttura della grafite può considerarsi di tipo molecolare. La struttura del diamante invece consiste di atomi di carbonio legati ad altri quattro atomi di carbonio ai vertici di un tetraedro ciascuno dei quali è legato ad altri quattro atomi di carbonio e così via. Non esistono molecole discrete e tutto il cristallo può essere considerato una macromolecola, e la struttura che ne deriva può essere ricondotta ad un reticolo cubico. In questa struttura gli atomi di C si sviluppano in puri legami covalenti sp3 che portano alla disposizione tetraedrica di 4 atomi di C attorno ad uno centrale distanti 1,54 Å l’uno dall’altro. I cristalli si presentano quasi sempre deformati con spigoli e vertici arrotondati, in quanto, formatisi a grandi profondità, hanno subito un’erosione superficiale durante il loro trasferimento verso la parte alta della crosta terrestre, lungo il camino diamantifero. Il diamante non è attaccabile dagli acidi e da qualsiasi agente chimico.
• QUANTO È DURO UN DIAMANTE?
Per durezza di un corpo solido s’intende la resistenza che esso oppone a lasciarsi scalfire da una punta o da uno spigolo di un altro corpo. I corpi solidi e in particolare i minerali presentano un diverso grado di coesione all’interno del reticolo, determinata dalla grande varietà di combinazione dei legami. Il concetto di durezza è assai indeterminato dal fatto che per la sua valutazione si debba ricorrere a criteri empirici di misurazione, riferiti alla resistenza che i minerali oppongono non solo alla scalfittura, ma anche all’abrasione e alla penetrazione. In mineralogia la scala usata è quella di Mohs, composta di una serie di minerali a durezza crescente. Purtroppo in tale scala, che va da 1(talco o grafite) a 10(diamante), i vari valori non sono ugualmente e matematicamente intervallati tra loro, ma si basa unicamente sulla sensazione tattile dello sperimentatore e mineralogista Friedrich Mohs che nel 1822 stilò questa scala. La scala utilizzata per determinare la resistenza all’abrasione è quella di Rosiwal che esprime un scalarità metrica assegnando il valore 1.000 al corindone. Tale scala però, come quella di Mohs, non consente di esprimere le differenze di durezza esistenti nelle diverse direzioni dei minerali anisotropi come è il diamante.
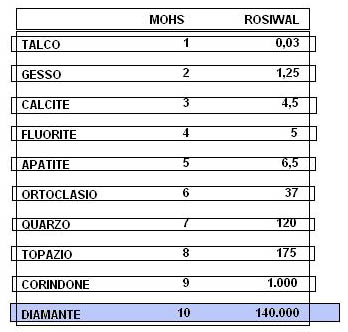
Il diamante, infatti, presenta anisotropia, ovvero diverso comportamento fisico con il variare della direzione, per quanto riguarda la durezza: maggiore nella direzione del vertice dell’ottaedro piuttosto che in quella dello spigolo. Avendo un reticolo cristallino molto compatto il diamante non è per niente elastico e conseguentemente è molto fragile e ciò comporta una particolare attenzione durante l’incastonatura, durante la quale la gemma può facilmente fratturarsi o scheggiarsi. Inoltre la facile sfaldatura lungo i piani dell’ottaedro viene sfruttata durante l’operazione di taglio del grezzo.
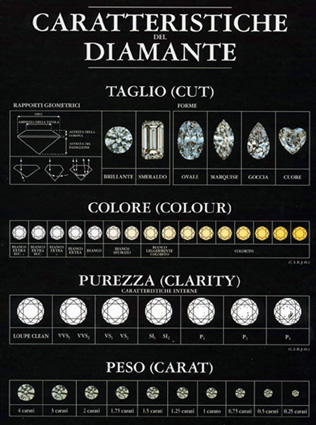
• LA GEOMETRIA DEL DIAMANTE
In ogni cristallo è possibile individuare una terna di elementi essenziali, noti come reali:
- facce, che sono le superfici poligonali delimitanti il cristallo nello spazio;
- spigoli, che sono i segmenti originati dall’incontro di due facce;
- vertici, che sono i punti ove s’incontrano tre o più spigoli.
Oltre agli elementi reali nei cristalli si devono prendere in considerazione anche altri elementi noti come ideali:
-piano di simmetria, il piano che divide il cristallo in due parti uguali, l’una speculare dell’altra;
-asse di simmetria, la retta intorno alla quale il cristallo viene fatto ruotare di 360°
-centro di simmetria, punto all’interno del cristallo che divide per metà tutte le rette
congiungenti gli elementi reali opposti(due coppie di facce, spigoli e
vertici).
-parametri, necessari per poter identificare nello spazio la giacitura delle facce di un cristallo si usa un sistema di riferimento di tipo cartesiano, con assi x,y,z e w(asse perpendicolare alle altre tre). L’intersezione della faccia fondamentale, che non sia parallela con gli assi x,y e z, individuerà rispettivamente tre segmenti, detti appunto,parametri a b c. Quando vi è una combinazione di forme si prende in considerazione la forma più evidente detta habitus cristallino.
L’insieme degli elementi di simmetria presenti in un cristallo determina il suo grado di simmetria. Esistono 32 classi di simmetria nelle quali vengono racchiusi, in ognuna, tutti i cristalli che presentano lo stesso grado di simmetria, anche quelli asimmetrici che non presentano elementi di simmetria. Le classi di simmetria vengono poi riunite in sistemi di ordine superiore detti cristallini: ne esistono 7, cubico, esagonale, trigonale, tetragonale, rombico, monoclino, triclino. Questi 7 sistemi vengono poi suddivisi dai cristallografi in tre gruppi:monometrico, dimetrico e trimetrico.
Detto ciò possiamo ora definire la geometria del diamante: esso fa parte del primo gruppo, quello monometrico(cristalli che hanno generalmente un aspetto rotondeggiante, con molte facce simmetriche uguali) con sistema cristallino cubico e habitus cristallino ottaedrico e esacistoedrico.
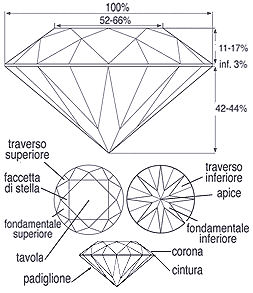
• CARATTERISTICHE OTTICHE
Dal punto di vista ottico il diamante è un minerale monorifrangente, in quanto la velocità di propagazione della luce è uguale in tutte le direzioni,e come tale è isotropo; in alcuni casi però può presentare una birifrangenza anomala, ovvero il raggio si scinde in due che vibrano in direzioni perpendicolari tra loro, dovuta ad irregolarità del reticolo cristallino sia per tensioni createsi durante il processo di cristallizzazione sia per la presenza di atomi estranei. Sottoposto a radiazioni UV evidenzia fluorescenza che può essere di colore blu, giallo, verde e rosa, di cui la blu è però la più frequente con intensità variabile. Quest’ultimo è un dato non trascurabile da parte dei laboratori di analisi gemmologica sia perché è un elemento riconoscitivo della gemma sia perché esso influisce sulla valutazione commerciale del diamante. Gli ultravioletti utilizzati per il rilevamento sono quelli a 366nm(manometri) e la fluorescenza viene classificata a seconda dell’intensità del fenomeno:nulla, lieve, media e forte.
RIFRATTOMETRO: PER CALCOLARE L’INDICE DI RIFRAZIONE DELLE GEMME

• CONDUCIBILITÀ TERMICA ED ELETTRICA
Il diamante per quanto concerne la conducibilità termica ed elettrica si comporta in modo anomalo: esso infatti ha un’elevata conducibilità termica (attitudine di una sostanza a trasmettere il calore) che si aggira tra i 1000 e 2600 W/m·K che non corrisponde con una buona conducibilità elettrica. Gli elettroni di valenza del carbonio, infatti, nel diamante sono tutti impegnati in legami covalenti e per questo esso è un isolante elettrico;differentemente nella grafite, considerata un semiconduttore, si ha in ogni atomo un elettrone di valenza libero di muoversi. Al contrario l’energia termica è trasmessa non dagli elettroni, ma dalle vibrazioni delle particelle formanti il cristallo. La rigidità del reticolo e la bassa massa degli atomi di C spiegano la sua elevata conducibilità termica (viene sfruttata in microelettronica per dissipare il calore). Il diamante inoltre non è fusibile, ma combustibile nell’aria a circa 850 °C.
• GENESI DEL DIAMANTE
I fattori che determinano la cristallizzazione del carbonio in forma di diamante o di grafite possono essere semplificati nella temperatura
e nella pressione al momento della cristallizzazione.
Il diamante è la varietà di carbonio di alta pressione. Studi di laboratorio hanno evidenziato che esso cristallizza con pressioni di almeno 50 kbar e temperature superiori a 900 °C. A pressioni o temperature più basse si forma la grafite.
A temperature superiori ai 1.200 °C, si forma nuovamente la grafite. A pressioni di circa 50 kbar quindi la formazione del diamante è limitata a temperature che vanno dai 900 °C ai 1.200 °C.
In natura pressioni di 50 kbar si riscontrano nello strato superiore del mantello terrestre ad una profondità tra 150 e 200 km.
Solitamente a queste profondità la temperatura supera i 1.200 °C eccetto nella parte inferiore dei vecchi cratoni stabili, che formano il nucleo dei vecchi continenti, dove le temperature a queste profondità sono comprese tra i 900 °C e i 1200 °C. Questi vecchi cratoni si formarono più di 2,5 miliardi di anni fa ed da allora non sono stati coinvolti importanti eventi tettonici..
Durante il trasporto verso la superficie il diamante attraversa zone con temperature e pressioni diverse a quelle del suo campo di stabilità. Necessariamente, quindi, il trasporto deve essere avvenuto in modo rapido per evitare la trasformazione del diamante in grafite o la sua combustione. La velocità di risalita di tali magmi (detti kimberlitici) è stata valutata intorno ai 40-70 Km/h. Resta un mistero la durata del processo che si ipotizza compreso tra i 900 milioni e i tre miliardi di anni.
La litogenesi del diamante è di tipo magmatico intrusivo: quando un magma, per ragioni diverse, si trova in ambiente di temperatura inferiore a quella di fusione, tende a raffreddarsi e se il raffreddamento avviene in profondità, a cristallizzare. Nella fase intrusiva le sostanze volatili come fluoro, cloro, boro e vapor d'acqua, partecipano molto scarsamente alla cristallizzazione, perciò si concentrano nel residuo magmatico, aumentando la pressione interna e mantenendo allo stato fuso il residuo stesso a temperature relativamente basse.
• TIPI DI DIAMANTI
I diamanti possono essere distinti in tre tipi I, II, III a causa dell’assorbimento nell’ultravioletto e nell’ifrarosso, della differente trasmissione della luce, la conducibilità termica ed elettrica e la presenza di atomi estranei nel reticolo cristallino.
Esistono poi in natura due tipi di diamante di colore grigia o nera, non trasparenti, dette rispettivamente bort e carbonado, che presentano una minore sfaldabilità e pertanto una maggiore resistenza meccanica; perciò il loro utilizzo è di tipo industriale, come polveri utilizzate nel taglio di altri diamanti, nella costruzione di seghe diamantate, di punte perforatrici, ecc… il bort presenta una struttura cristallina composta da sferette raggiate, mentre il carbonato è un aggregato cristallino poroso.
|
