
Nell’ottobre del 1996 fu assegnato il premio Nobel per la chimica ai ricercatori Harold Kroto, Robert F. Curl ed a Richard E. Smalley per la scoperta dei fullereni, l’unica forma finita del carbonio. Le altre due, il diamante e la grafite, sono, infatti, solidi a reticolo infinito. Il fullerene riceve il suo nome dall’architetto Buckmister Fuller, che progetta abitazioni a forma di cupola geodetica basata su pentagoni ed esagoni, a volte viene anche indicato come “buckyball”.
Gli esperimenti che portarono alla scoperta della molecola di C60, erano indirizzati a simulare in laboratorio l’atmosfera ricca di carbonio di una stella gigante rossa contenente gas come idrogeno e azoto.
La macchina usata da Smalley per generare un insieme di molecole di carbonio è schematicamente mostrata in figura
|
|
|
Diagramma dell’impianto usato per produrre e analizzare le molecole di carbonio. L’“Integration Cup” è opzionale |
Il laser (10000°C) colpisce un disco di grafite che ruota, producendo plasma d’atomi di carbonio vaporizzati. Una beccuccio fa passare nella zona di vaporizzazione dell’elio ad intervalli. L’elio provvede a creare le condizioni termiche affinché gli atomi di carbonio si raffreddino e si raggruppano. L’elio fa anche da “vento” per spostare i cluster fino allo spettrometro di massa, dove i cluster si espandono a velocità supersonica, attraverso l’apparato opzionale “integration cup”.
|
Numero d’atomi di carbonio per cluster |
Kroto e Smalley scoprirono che la varietà dei cluster di carbonio dipendeva dalle condizioni in cui era eseguito l’esperimento. Se il laser veniva attivato quando sul piatto di grafite passava la massima quantità d’elio, il picco relativo al numero di cluster di C60 diventava molto più forte di quelli vicini (ad eccezione del picco di C70). Quando a queste condizioni era aggiunto l’”integration cup”, che aumenta il tempo tra vaporizzazione ed espansione, allora la distribuzione di cluster era completamente dominata dal C60.
La spiegazione di questi risultati fu che i cluster ancora caldi se lasciti a contatto con l’elio cercano di formare strutture più stabili, che da grafici sembra essere il cluster che contiene 60 atomi di carbonio.
La struttura del carbonio C60 è quella di un icosaedro troncato, cioè quella di un icosaedro cui sono stati troncati i 12 vertici. Ogni vertice è quindi sostituito da un pentagono. Alla fine la molecola di C60 sarà perfettamente uguale ad un pallone da calcio
|
|
|
Icosaedro
a sinistra ed Icosaedro troncato a destra |
Il fullerene C60 è costituito da 12 pentagoni e 20 esagoni, con ciascun pentagono circondato da cinque esagoni. Questa rappresenta la molecole più simmetrica possibile nello spazio euclideo tridimensionale, essendo “la più rotonda” delle molecole rotonde.
La gabbia del fullerene ha un diametro tra i 7 ed i 15 angstroms. Il C60 ha un diametro di circa 7 angstroms, cioè 10 volte più grande di un atomo.
Nella struttura del C60 ogni vertice dell’icosaedro troncato è occupato da un atomo di carbonio ed ogni atomo di carbonio è legato con tre altri atomi da un doppio legame covalente e due legami singoli. Gli atomi di carbonio che formano questo tipo di legami, s’indicano di solito con “carbonio sp2”, quando il carbonio è ibridato sp2, utilizza orbitali originati dall’ibridazione di un orbitale s con due orbitali p. I tre orbitali ibridi che si ottengono sono diretti verso i vertici di un triangolo equilatero e formano tra loro un angolo di 120°.
I tre orbitali danno luogo a tre legami covalenti di tipo sigma (s). In questo tipo d’ibridazione il carbonio dispone ancora di un orbitale di tipo p in cui si muove un elettrone. La sovrapposizione di quest’orbitale, che è disposto perpendicolarmente al piano contenente i tre legami s, con lo stesso di un altro atomo di carbonio dà luogo alla formazione di un legame covalente di tipo pi greco (p).
In conclusione nel fullerene il carbonio ibridato sp2 è caratterizzato da un doppio legame, uno sigma ed uno pi greco. Di solito gli atomi di carbonio sp2 e i suoi tre vicini sono complanari. Nella grafite, ad esempio, gli orbitali che danno luogo ai legame pi greco (p) sono tutti paralleli tra loro e perpendicolari al piano della grafite creando un piano infinito con un mare di elettroni-p sopra e sotto il piano. Ciò ovviamente non accade nella struttura del C60 che non è planare. L’angolo tra il legami s e l’asse che contiene l’orbitale che da luogo al legame p è di 101.6° (rispetto ai 90° della grafite).
|
|
|
Theta (
|
La concavità che si forma tra gli atomi di carbonio introduce delle tensione nella molecole. In ogni caso, l’alta simmetrica distribuisce uniformemente le tensione su tutta la struttura.
|
|
|
Struttura del C
|
La struttura ad icosaedro troncata non è la sola forma possibile dei fullereni. Ci sono infatti molti tipi di gabbie che possono essere costruite con esagoni e pentagoni. La cosa interessante è che ogni tipo di struttura deve contenere sempre 12 pentagoni, qualsiasi sia il numero di esagoni. I pentagoni sono necessari per avere una struttura chiusa (la grafite, che è composta solo da esagoni, è planare) Il numero di vertici in qualsiasi forma di fullerene è necessariamente pari.
Il più piccolo fullerene possibile è il C20,
che contiene 20 pentagoni e nessun esagono. Comunque questo
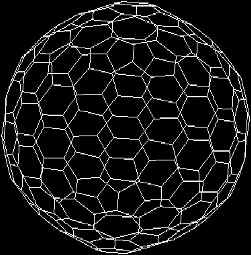 tipo
di struttura ha forti tensioni interne perché la forma di ogni molecola di
carbonio è fortemente non planare. Altri possibili fullereni sono C28,
C32, C44, C50, C58, C70,
C76, C84, C240, C540, C960 e
molte altre. Qui a lato è mostrata la struttura di una molecola di fullerene C240.
tipo
di struttura ha forti tensioni interne perché la forma di ogni molecola di
carbonio è fortemente non planare. Altri possibili fullereni sono C28,
C32, C44, C50, C58, C70,
C76, C84, C240, C540, C960 e
molte altre. Qui a lato è mostrata la struttura di una molecola di fullerene C240.
Delle forme di fullerene la più comune dopo il C60 è il C70, le altre sono molto rare.
Dato che le tensioni interne delle molecole si accumulano intorno ai pentagoni che sono i responsabili della chiusura, le strutture che non hanno pentagoni contigui (con un lato in comune) sono particolarmente stabili. Le forme più piccole in cui si realizza questa condizione sono quelle del C60 e del C70.
Si fa spesso riferimento al bulk del C60 allo stato solido col termine di fullerite. La fullerite a temperature ambiente adotta la struttura di cubo a facce centrate (fcc) con un distanza interatomica di 14.17Å. La particolarità è che nei cristalli di fullerite, al posto di ogni atomo, c’è una molecola di fullerene.
|
|
|
Sinistra) Cella cubica a facce
centrate. Destra) Strati di sfere in un struttura cubica a facce
centrate (fcc). |
L’alto numero di elettroni che circondano la molecola di fullerene, provenienti dal legame p, facilita la formazione di un momento di dipolo, ciò a causa della distorsione della simmetria sferica della distribuzione degli elettroni. Questo porta alla formazione di legami di Van der Waals.
La fullerite è un isolante elettrico, infatti ha un gap di –2.3 eV tra gli strati elettronici occupati e quelli immediatamente liberi. È solido fino a circa 800°K dopo sublima. Al di sopra di 260°K (-13°C), le sfere sono libere di ruotare nelle loro posizioni cristalline. Abbassando la temperatura, cominciano a rallentare orientandosi in alcune direzioni. Alla fine, tra i 100°K ed i 90°K (la temperatura dipende dalla velocità con cui è raffreddato il sistema), le sfere di fullerene sono completamente bloccate. Tuttora non si comprendono ancora alcuni aspetti di questo processo di raffreddamento.
La molecola di C60 è molto elettronegativa, cioè forma velocemente dei composti con gli atomi che sono pronti a donarle degli elettroni. Dato che i metalli alcalini (Na, K, Rb, Cs) sono altamente elettropositivi, rappresentano i candidati ideali a legarsi con il C60. Infatti trattando il C60 con tre atomi alcalini si arriva alla produzione di A3C60, mentre mettendo a contatto sei atomi alcalini col fullerene si ottiene A6C60.
L’ A3C60 è conduttore a temperatura ambiente perché ha la “banda di conduzione” solo parzialmente riempita. Gli elettroni possono muoversi tra le molecole di C60 gli orbitali dei legami pi greco (p). A bassa temperatura, A3C60 diventa superconduttore (19°-40°K). Invece il composto A6C60 è un isolante perché non ha elettroni di conduzione liberi.
Il sistema A3C60 continua ad avere una struttura cubica a facce centrate (fcc), aumentando leggermente la costante di impacchettamento per far entrare i cationi dei metalli alcalini. La ragione per cui può essere conservata la struttura fcc è che questa contiene per ogni sfera di C60 tre siti interstiziali, uno ottaedrico e due tetraedrici.
|
|
|
Posizione dei siti interstiziali ottaedrici
(sinistra) e quelli tetraedrici (destra) relativi ad una cella cubica a
facce centrate |
Il sistema A6C60 contiene il doppio del numero di ioni alcalini che possono entrare nella cella fcc. È necessaria quindi una riorganizzazione della struttura che passa da cubica a facce centrate (fcc) a cubica a corpo centrato (bcc). Questa riorganizzazione, che posiziona le molecole di C60 al centro ed ai otto vertici della cella cubica, da maggiore spazio agli ioni alcalini.